Прежде чем перейти к статье, хочу вам представить, экономическую онлайн игру Brave Knights, в которой вы можете играть и зарабатывать. Регистируйтесь, играйте и зарабатывайте!

Как только приходят зимние морозы, многие люди начинают страдать от насморка, кашля, боли в горле и прочих симптомов того или иного простудного заболевания. Учитывая ситуацию с пандемией, малейший чих порождает мысли о вероятном инфицировании злосчастным вирусом. Однако далеко не все простудные (и не только) болезни имеют вирусное происхождение, ведь есть еще грибковые и бактериальные. В случае последних чаще всего назначаются антибиотики, способные бороться либо с определенной бактерией, либо широкого спектра действия. Эти лекарства могут вылечить больного довольно быстро и эффективно, но, как и многие другие препараты, обладают рядом побочных эффектов и последствий. Одним из таких нежелательных аспектов является нарушение микрофлоры внутри организма, т.е. дисбактериоз. Дело в том, что антибиотики могут, уничтожая вредоносную бактерию, «задеть» и тех, что в нашем теле заняты благим делом (например, помогают пищеварению). И вот ученые из университета Дьюка (США) провели исследования методики лечения дисбактериоза, которую лемуры применяют буквально с рождения. Основная суть этой методики — трансплантация фекальных бактерий. Как работает такое лечение, какие бактерии используются, и насколько данная методика эффективна? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
В природе существует немало примеров симбиоза между представителями разного вида. Такого рода сотрудничество, в отличие от паразитизма, несет пользу обеим сторонам. Посему нет ничего удивительного, что позвоночные, населяющие Землю миллионы лет, сформировали симбиотические отношения с организмами, которых и увидеть то нельзя без микроскопа. Куда логичнее сказать, что именно микробиота является инициатором взаимовыгодных отношений.
За долгие годы коэволюции многие микроорганизмы, поселившиеся в организмах животных, в том числе и в людях, выработали определенные системы взаимодействия, основанные на выполнении тех или иных функций внутри организма носителя. Нарушение работы микробиоты может иметь как краткосрочные, так и долгосрочные негативные последствия для организма носителя.
К примеру, антибиотики борются с вредоносными бактериями, но могут косвенно влиять и на полезные, уменьшая их численность, повышая восприимчивость организма к вредным патогенам и ухудшая функции микробиоты в целом. Куда опаснее то, что такие препараты могут изменять микробный геном, вызывая у определенных бактерий устойчивость к антибиотикам (сокращенно ABR от antibiotic resistance).
Гены, отвечающие за ABR, существуют уже очень давно. Их основная задача заключается в выживании микроба в условиях повышенной конкуренции в густонаселенных сообществах внутри или вне хозяина. Способность бактерий быстро мутировать и делиться полезными генами посредством латерального переноса генов привела к появлению множества встречающихся в природе ABR генов.
Реакция микробного сообщества на природные антибиотики в значительной степени определяется взаимодействиями между микробными таксонами, которые меняются со временем и в разных средах. Эффективность и повсеместное распространение искусственных антибиотиков серьезно нарушили микробные сообщества за счет целевого (например, узкого спектра) или неизбирательного (например, широкого спектра) уничтожения бактериальных групп, тем самым изменяя состав и, в конечном итоге, функциональный потенциал микробиомов. Кроме того, эти антибиотики усиливают селективное давление на бактериальные сообщества, делая ABR гены еще полезнее и стимулируя их пролиферацию, тем самым изменяя геномный состав микробиоты.
В микробиомах внутри носителя распространение ABR может привести к появлению вирулентных, устойчивых патогенов, которые уменьшают разнообразие природных или полезных микробов и снижают иммунную способность организма носителя.
Проблема в том, что несмотря на широкое применение антибиотиков, нам крайне мало известно о том, как именно они влияют на полезную микробиоту. Исследования и опыты, связанные с этим вопросом, часто ограничиваются определенной группой позвоночных (чаще всего, человекоподобные приматы). Однако, лемуры, к примеру, прошли уникальный эволюционный путь, делающий их крайне интересными моделями для изучения динамики взаимодействия между носителем и его микробиотой.

Семейство кошачьих лемуров.
Кошачий лемур (Lemur catta) является эндемиком Мадагаскара, т.е. обитает исключительно на этом острове. Они очень социальные животные, формирующие группы от 20 до 30 особей, где главенствуют чаще всего самки. Питаются они по большей части растительностью, но не брезгуют и насекомыми. Любопытной анатомической особенностью лемуров является наличие у самцов специальных желез на лапах. С помощью острых когтей они царапают кору деревьев, оставляя на нем свой запах, тем самым помечая территорию. Несмотря на свой миловидный внешний вид, лемуры очень ревностно защищают свою территорию, особенно от особей из других групп.
Для данного исследования важным является то, что у лемуров специфическая микробиота, и они очень устойчивы к различным заболеваниям (особенно болезням ЖКТ). Еще один любопытный факт — детеныши лемуров едят фекалии своих матерей. Ученые предполагают, что это напрямую связано с передачей полезных микроорганизмов.
Учитывая вышесказанное, ученые решили провести опыты на лемурах, дабы установить истинность (или наоборот) двух гипотез, касающихся восстановления микробиома внутри носителя.
Первая гипотеза о восстановлении заключается в том, что разнообразие видов микроорганизмов улучшает стабильность всего микробного сообщества, поскольку увеличивает функциональную избыточность. Согласно этой гипотезе, восстановление альфа-разнообразия (общий состав микробиомы), независимо от микробной идентичности, должно быть жизненно важным для достижения стабильного микробиома.
Соответственно, после лечения антибиотиками можно ожидать увеличения микробного разнообразия (например, альфа-разнообразия), независимо от трансфаунации (трансплантации) фекалий. Таким образом, полученные стабильные сообщества двух экспериментальных групп могут иметь одинаковую степень разнообразия, но разный состав.
Вторая гипотеза состоит в том, что определенные члены сообщества (т.е. ключевые виды микроорганизмов) являются основой функционирования сообщества. Посему восстановление стабильного микробиома требует определенного состава сообщества (т.е. бета-разнообразия).
В соответствии с этой гипотезой ученые предполагают, что после нарушения, вызванного антибиотиками, должно произойти восстановление того же состава сообщества, при этом трансфаунация фекалий будет способствовать или ускорять скорость восстановления. Соответственно, полученные стабильные сообщества обеих терапевтических групп в конечном итоге будут иметь аналогичный состав.
Эти гипотезы могут работать сообща либо быть альтернативами друг другу. К примеру, разнообразие микроорганизмов может восстанавливаться быстро, а композиция сообщества медленно.
Результаты опытов
Лемуры, участвующие в экспериментах, были разделены на три группы:
- контрольная (CON);
- после антибиотиков (ABX)
- после антибиотиков и трансфаунации фекалий (ABXFT).
До опытов у всех особей из всех трех групп не было обнаружено каких-либо существенных отличий в альфа- и бета-разнообразии. Аналогичным образом, во всех контрольных образцах (т.е. во всех трех фазах исследования, включая предварительную обработку, лечение и восстановление особей из CON; n = 184) доминирующие бактериальные таксоны (изображение №1), а также альфа (изображение №2) и бета (изображение №3) разнообразия оставались относительно стабильными в течение каждого из четырехмесячных периодов исследования, демонстрируя постоянство в течение сезона размножения.
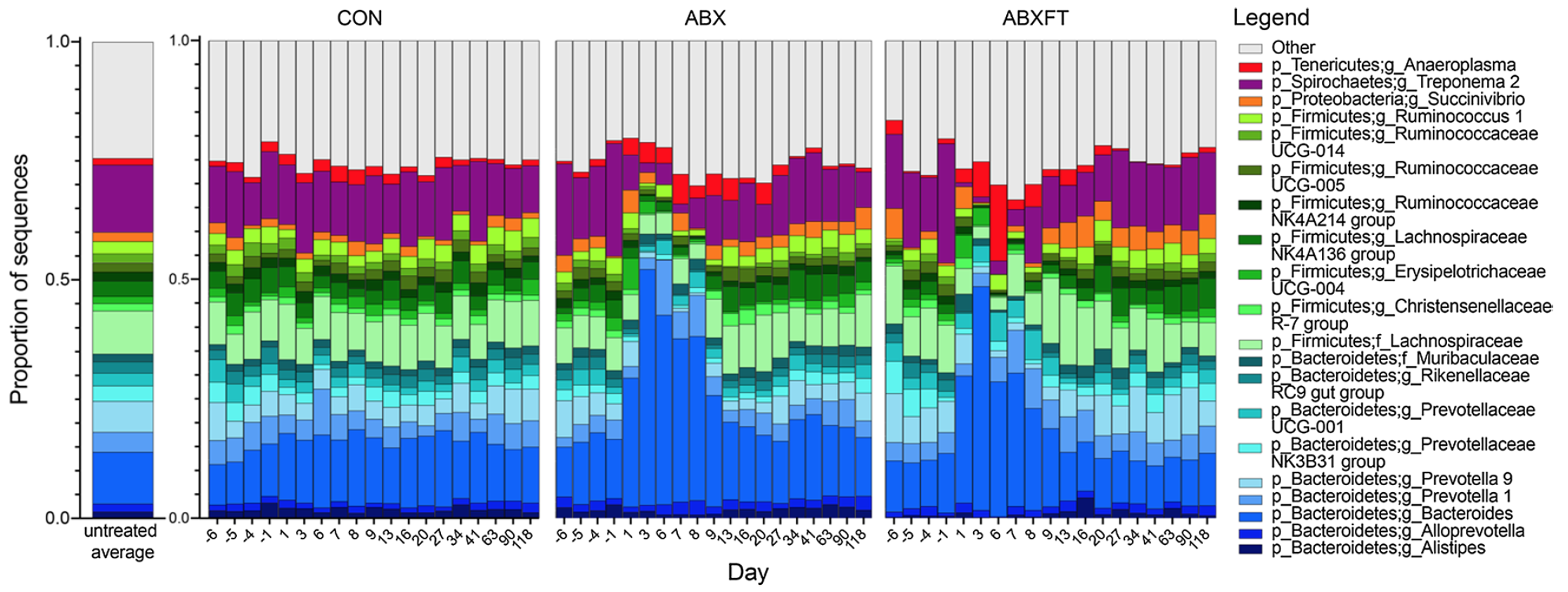
Изображение №1: средняя относительная численность бактериальных родов с течением времени в микробиомах кишечника трех экспериментальных групп самцов Lemur catta.
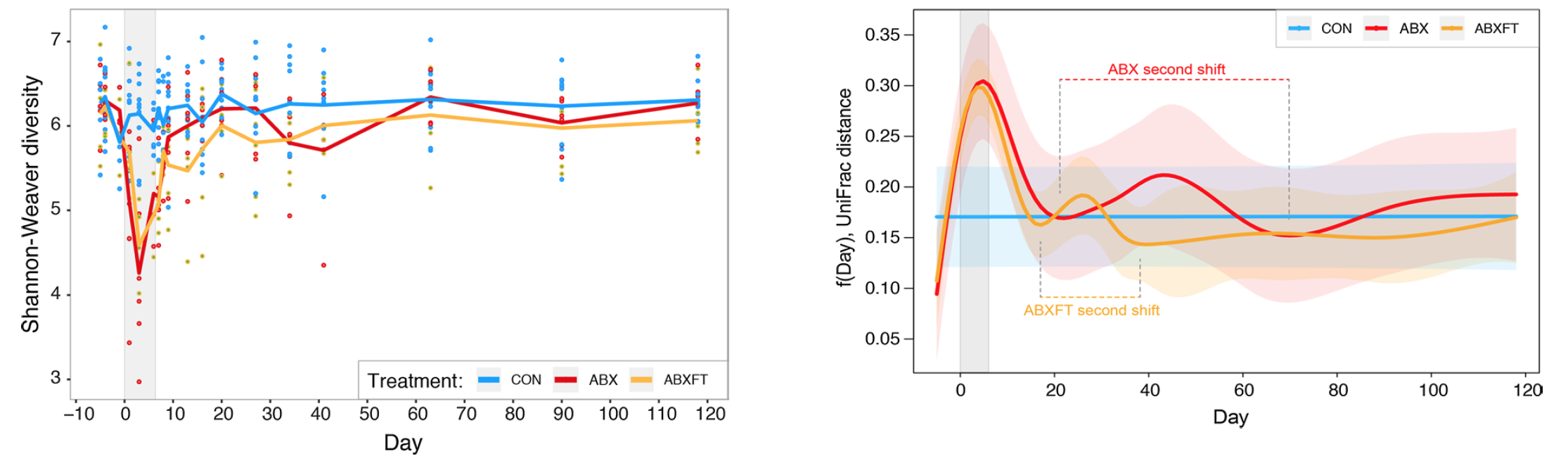
Изображения №2 и №3: альфа-разнообразие с течением времени в трех экспериментальных группах (слева); бета-разнообразие с течением времени в трех экспериментальных группах (справа).
Объединяя данные по фазе до обработки двух групп (исходные образцы; n = 43) с контрольной группой, в бактериальной микробиоте кишечника здоровых особей преобладали таксоны Bacteroidetes и Firmicutes, а также в меньшей степени присутствовали Proteobacteria, Spirochaetes и Tenericutes.
В ходе сравнительного анализа трех групп лемуров было обнаружено значительное влияние фекальной трансплантации на альфа-разнообразие: по сравнению с животными CON группы, животные из ABX и ABXFT имели значительно более низкие баллы (изображение №2).
Во время фазы лечения антибиотиками особи из группы ABX и ABXFT в отличие от особей из группы CON показали ожидаемое и быстрое снижение альфа-разнообразия. Учитывая, что амоксициллин является антибиотиком широкого спектра действия, у здоровых лемуров он вызвал значительное сокращение численности многих таксонов бактерий (Firmicutes, Ruminococcaceae, Lachnospiraceae и т.д.). Однако на некоторых бактерий антибиотик не повлиял или же привел ок обратному эффекту (например, бактерий из семейства Parabacteroides стало в разы больше).
Во врем фазы восстановления было обнаружено, что у особей, получивших антибиотик, альфа-разнообразие разительно отличалось от контрольной группы в течение 4 месяцев после обработки. Это свидетельствует о том, что антибиотик вызвал долговременный дисбаланс микрофлоры. Отличия в альфа-разнообразии между группами ABX и ABXFT были незначительны.
Куда важнее, что группа ABXFT показала устойчивое увеличение альфа-разнообразия после приема антибиотиков, что согласуется с первой гипотезой, называемой учеными «разнообразие рождает стабильность».
Проверка бета-разнообразия во время фазы обработки антибиотиком показала, что у особей из группы ABX состав микробного сообщества был намного беднее, чем у особей из группы CON. Другими словами, антибиотик убил множество бактерий с точки зрения видов, а не их численности.
На фазе восстановления группа ABXFT показала схожие с CON уровни бета-разнообразия. Это свидетельствует о том, что фекальная трансплантация имела положительный эффект, а вторая гипотеза («ключевые виды») подтверждается.
На протяжении всего эксперимента бактериальный состав особей из группы ABX продолжал колебаться, тогда как у особей ABXFT группы бактериальный состав становился относительно стабильным примерно через 2 недели после фазы лечения, т.е. после фекальной трансплантации. К концу эксперимента уровни бета-разнообразия особей из групп ABXFT и CON стали практически идентичными, что говорит о полном (или почти полном) восстановлении микробиомного разнообразия.
Чтобы охарактеризовать бактериальные ковариации в кишечнике лемуров, был использован анализ парных ковариаций, который выявил несколько сильных ковариаций между парами микробных таксонов в микробиомах кишечника лемуров.
Первая ковариация была между родом Cerasicoccus и отрядом WCHB1-41, которая проявлялась на всех этапах исследования. Вторая — между родом Cerasicoccus и отрядом Rhodospirillales (проявлялась на этапе восстановления). Эти две взаимосвязи отражают мелкомасштабную, но общую микробную динамику, которая происходит в здоровых, необработанных антибиотиком микробиомах.
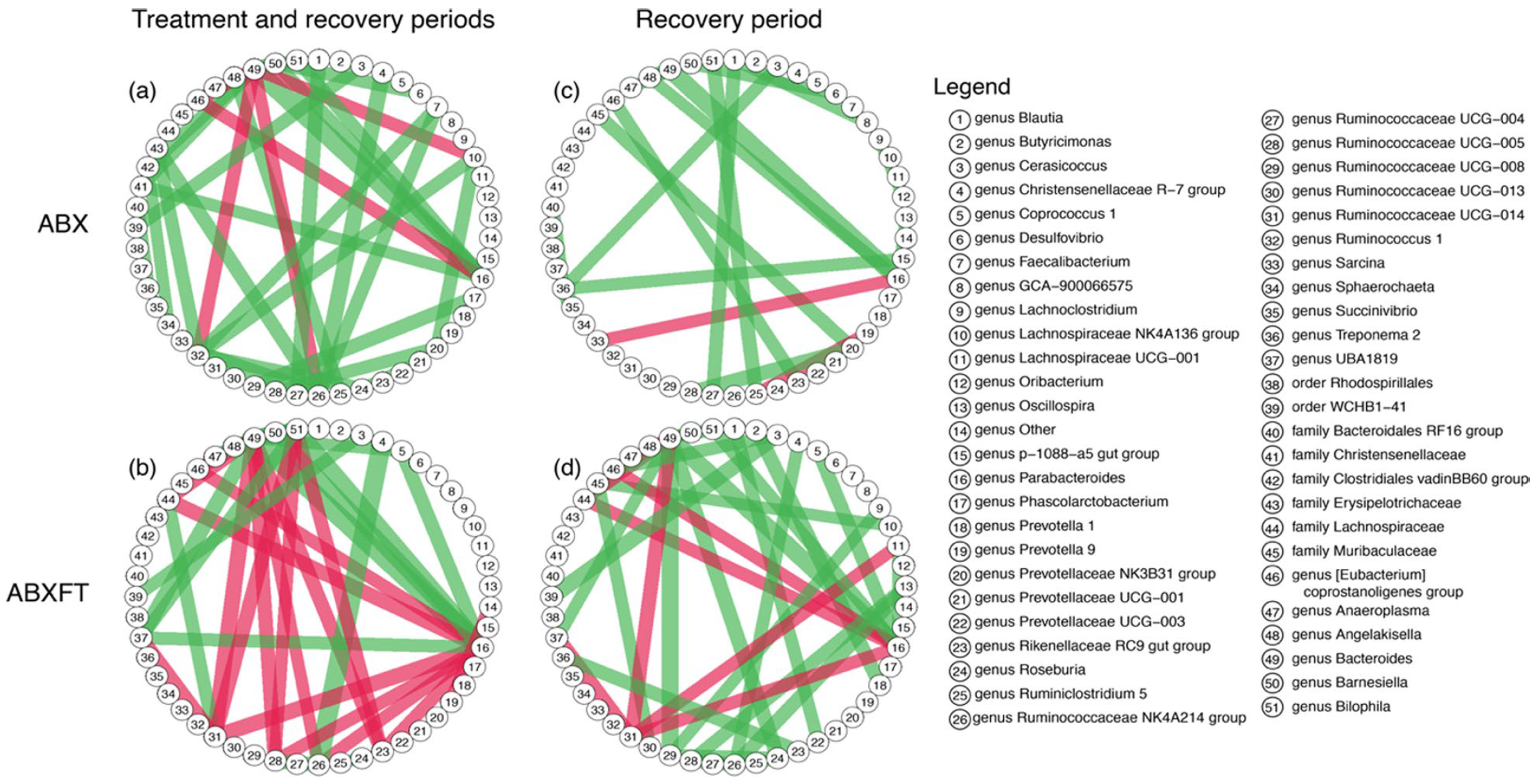
Изображение №4: бактериальные ассоциации здоровых особей, которых лечили либо антибиотиками, либо антибиотиками + фекальной трансфаунацией. Цвета линий представляют направление корреляции (зеленый = положительная, красный = отрицательная), ширина линии соответствует величине корреляции.
Внутри более изменчивой кишечной микробиоты лемуров ABX и ABXFT было выявлено 35 и 31 сильная ассоциация, соответственно (4a и 4b). У животных ABX эти ассоциации были преимущественно положительными, только с шестью отрицательными, тогда как у лемуров ABXFT положительные и отрицательные ассоциации были представлены в равной степени (15 и 16 соответственно). Общими для ABX и ABXFT было 10 ассоциаций (8 положительных и 2 отрицательных). В рамках этих общих ассоциаций девятеро были представлены либо Parabacteroides, либо Bacteroides (12 и 39 на изображении выше). Положительная связь между этими двумя таксонами была самой сильной ассоциацией для ABX и ABXFT. Более того, у животных ABX и ABXFT логарифмические отношения численности Parabacteroides и Bacteroides показали увеличение во время фазы обработки.
Поскольку анализ логарифмических соотношений представляет отношения между численностью конкретных таксонов относительно средней численности всех других таксонов, закономерности увеличения логарифмов могут отражать три возможности: численность Parabacteroides и Bacteroides действительно увеличивается; остается стабильной, пока среднее значение уменьшается; или уменьшается менее резко, чем среднее значение.
Независимо от варианта, можно предположить, что эти два таксона не пострадали от обработки антибиотиком (изображение №5).
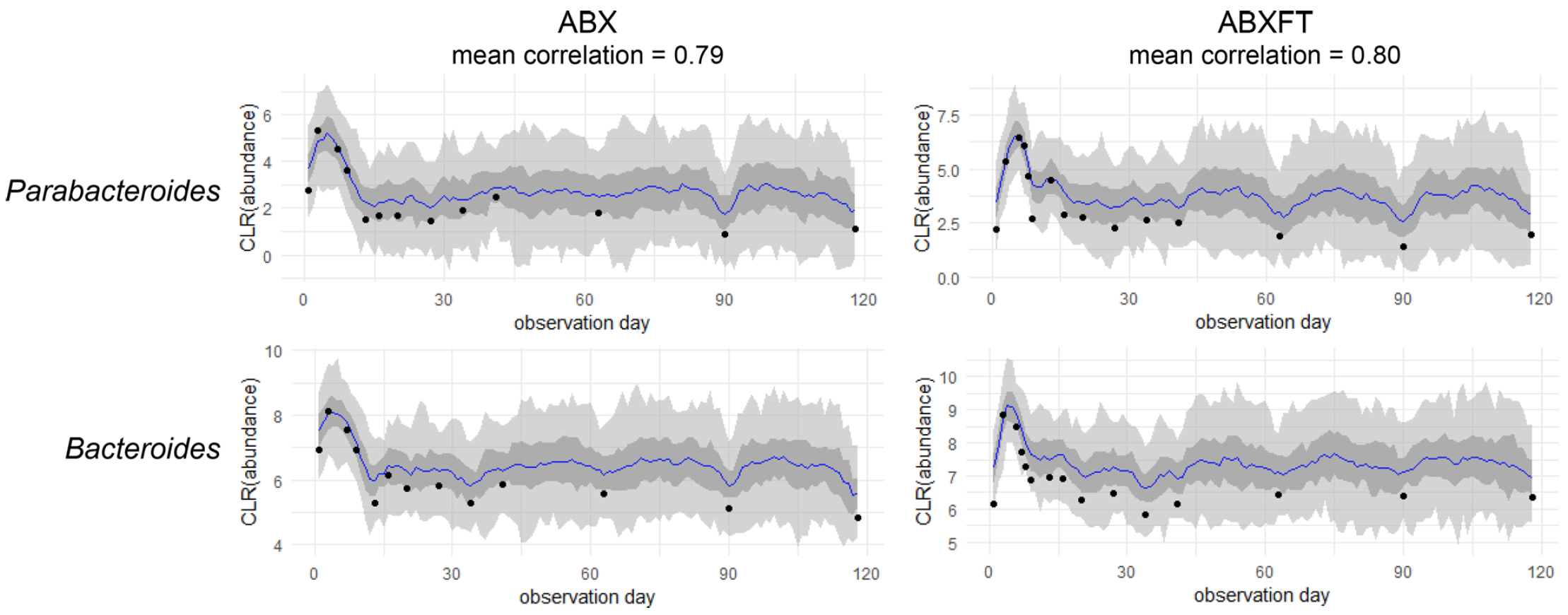
Изображение №5: графики корреляции для связи между централизованным логарифмическим соотношением (CLR; черные точки) численности Bacteroides и Parabacteroides у особей, получавших либо только антибиотики, либо антибиотики и трансфаунацию фекалий.
Большинство сильных парных ассоциаций с Parabacteroides или Bacteroides были положительными. Это указывает на то, что ассоциированные таксоны также противостоят антибиотикам, возможно, благодаря общим ABR-генам.
Во время фазы восстановления микробиота кишечника животных ABX сохранила только 20 (18 положительных и 2 отрицательных) из исходных 35 ассоциаций (4c). Это отражает сокращение бактериальных таксонов, которые выжили после применения антибиотика. Но вот микробиота особей из группы ABXFT (4d) сохранила то же число ассоциации — 31 (23 положительных и 8 отрицательных).
Анализ методом дробовика* 30 образцов фекалий выявил 3.2 миллиона последовательностей, которые были отнесены к 83 известным ABR-генам.
Метод дробовика* — метод секвенирования длинных участков ДНК, суть которого состоит в получении случайной массированной выборки клонированных фрагментов ДНК данного организма, на основе которых может быть восстановлена исходная последовательность ДНК.В среднем большинство обнаруженных ABR-генов принадлежало к четырем семействам генов устойчивости: тетрациклин (51.4 ± 3.44%); бета-лактам (29.5 ± 3.17%); аминогликозид (7.9 ± 2.25%) и макролид (1.2 ± 0.24%). Также присутствовал небольшой процент (менее 1%) генов семейства ванкомицина, устойчивого к сульфонамидам.
Любопытно то, что у двух особей, которых никогда не лечили антибиотиками, все же были найдены ABR-гены. Еще любопытнее то, что уровень этих генов соответствовал таковому у особей, которых ранее неоднократно лечили антибиотиками (изображение №6).
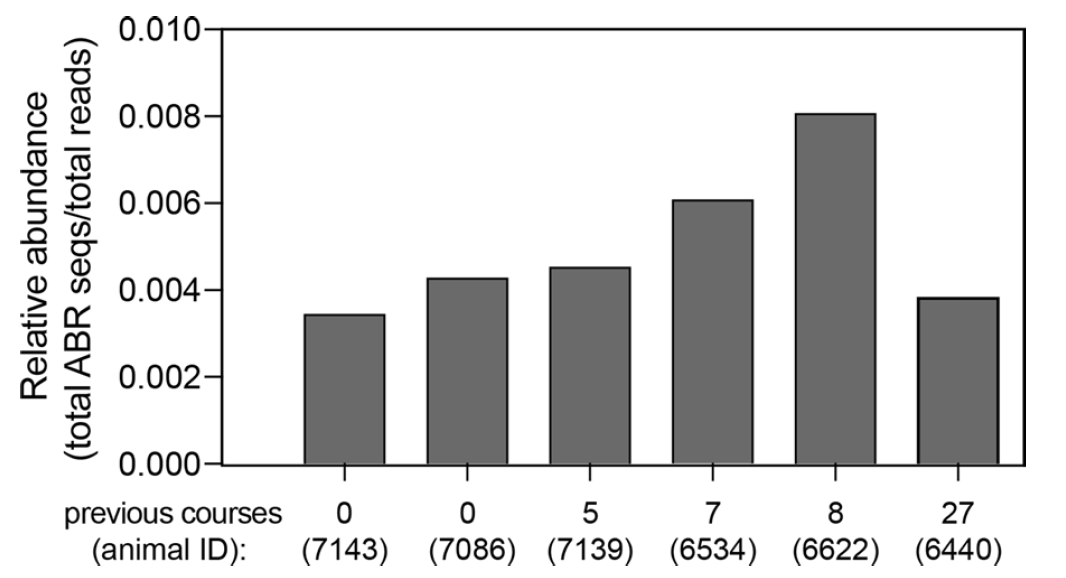
Изображение №6: относительное количество генов устойчивости к антибиотикам (ABR) у шести особей, которые в течение своей жизни прошли разное количество курсов лечения антибиотиками.
Кроме того, одна особь, получившая наибольшее количество курсов лечения антибиотиками (n = 27 курсов), занимала второе место по численности ABR-генов, как животные, которые ранее не получали лечения.

Изображение №7: доля генов устойчивости к антибиотикам (ABR), выявленная у особей из групп CON, ABX и ABXFT. Цветами отмечена резистентность по отношению к определенному типу антибиотиков, MDR (Multi-Drug Resistant) — мультирезистентность.
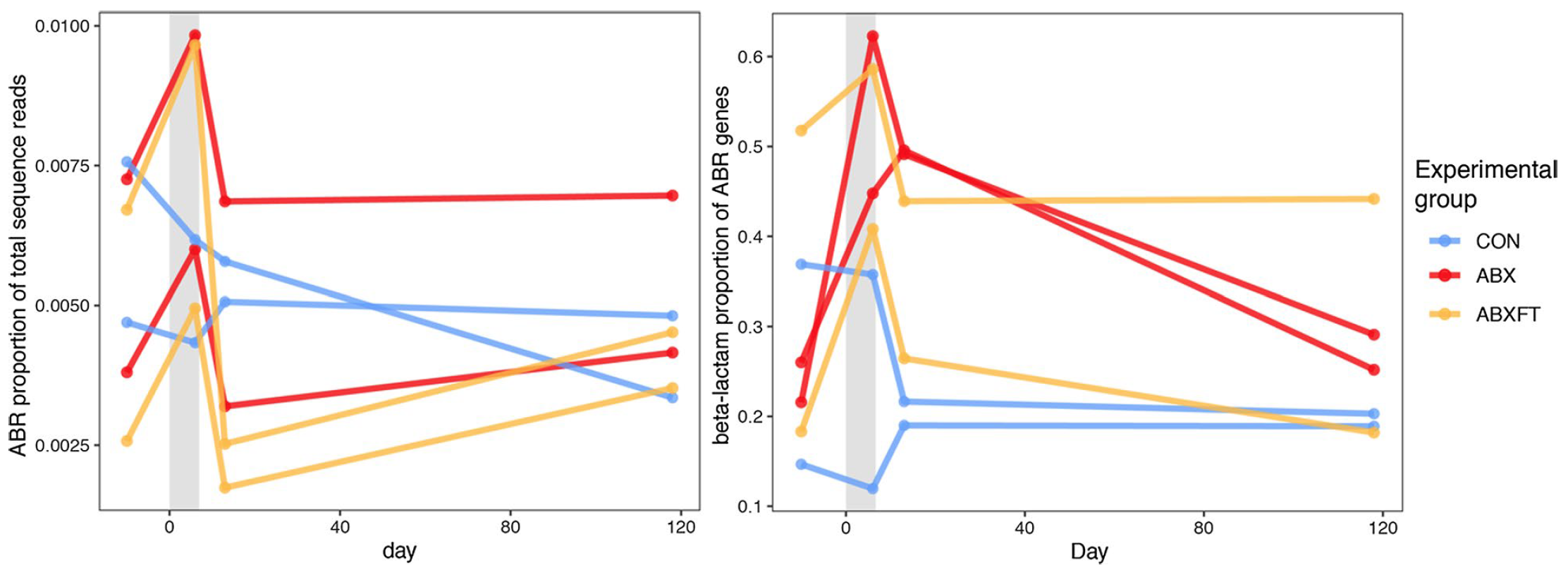
Важно отметить, что относительная численность ABR-генов варьировалась среди разных особей (изображения №7 и №8). У особей из группы CON численность ABR-генов показала небольшие вариации. А вот у особей из ABX и ABXFT численность ABR увеличивалась между фазами предварительной обработки и обработки. Однако во время фазы восстановления численность ABR-генов уменьшалась.
Изображение №8: паттерны устойчивости к антибиотикам у особей из групп CON, ABX и ABXFT.
Аналогичным образом, по сравнению с группой CON, группы ABX и ABXFT показали увеличение доли генов устойчивости к бета-лактамам во время фазы обработки антибиотиков, что отражает влияние лечения бета-лактамным антибиотиком (т.е. амоксициллином).
Доля генов устойчивости к бета-лактамам во время ранней постобработки была выше у животных из группы ABX по сравнению с ABXFT (изображение №8). Это может указывать на потенциальное смягчающее влияние фекальной трансфаунации на устойчивость ABR в микробиомах кишечника лемура.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В рассмотренном нами сегодня труде ученые уделили особое внимание микробиоме кишечника кошачьих лемуров, отличающихся крепким здоровьем, особенно в рамках ЖКТ. Основная задача труда заключалась в пояснении эффекта, который фекальная трансплантация может иметь на микробиому животного, подвергшегося лечению антибиотиками.
Антибиотики, несмотря на свою пользу, имеют ряд негативных эффектов, среди которых самым явным является нарушение баланса микробиома внутри организма. Убивая вредоносные бактерии, антибиотик затрагивает и тех, что приносят носителю пользу. В результате в организме образуется недостача, которая может породить развитие других бактерий, польза от которых может быть сомнительна.
Метод трансплантации фекалий основан на передаче микробиома от здоровой особи к той, что была обработана антибиотиками. Результаты сравнительного анализа трех групп испытуемых (контрольная, после антибиотиков и после антибиотиков и фекальной трансплантации) показали значительное снижение численности и разнообразия микробиоты в кишечнике лемуров, которых лечили препаратами. Однако, после применения трансплантации уровни разнообразия микробных сообществ и их численность начали восстанавливаться, достигая со временем исходных (до антибиотика) уровней.
Ученые считают, что их труд позволяет лучше понять динамику отношений между организмом-носителем и микрофлорой, которая в нем обитает. Поскольку антибиотики являются неотъемлемой часть современной медицины, понимание того, как они могут нарушать этот хрупкий симбиотический баланс, позволяет лучше бороться с его нежелательными побочными эффектами, такими как дисбактериоз.
Пятничный офф-топ:
Лемуры, как и многие другие обитатели Земли, обладают рядом необычных, но очень полезных для их вида особенностей.
Лемуры, как и многие другие обитатели Земли, обладают рядом необычных, но очень полезных для их вида особенностей.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?




