Прежде чем перейти к статье, хочу вам представить, экономическую онлайн игру Brave Knights, в которой вы можете играть и зарабатывать. Регистируйтесь, играйте и зарабатывайте!

В этой статье мы изложим новую, пока ещё фантастическую, идею о том как с помощью информационных технологий можно победить рак. Быть может, полностью. Мир без рака возможен. В некой перспективе, близость которой зависит от нас.
Это лонгрид. Поэтому вначале будет оглавление, чтобы нетерпеливые могли нырнуть к самым горячим моментам: применяем IT-подход в биологии (пункт 4), наивная реализация контрольных сумм в ДНК (пункт 5.1), сложная реализация (пункт 5.2). Но перед комментированием желательно прочесть весь текст.
Идея пока ещё не обросла всеми нужными деталями для реализации. Предложения приветствуются. За найденные ошибки в тексте повышаю карму.
1. Что такое рак?
1.1 Это серьёзная проблема человечества
1.2 Определение рака
1.3 Как лечат рак сегодня?
1.3.1 Старые методы
1.3.2 Недостатки старых методов
1.3.3 Новые и экспериментальные методы
2. Причины рака
3. Информационные технологии против рака
3.1 Более надёжное копирование
3.2 Резервная копия
3.3 Избыточность и репарация in place
3.4 Контрольные суммы
3.5 База данных с сигнатурами вирусов
3.6 Удаление спящих вирусов
3.7 Как ДНК защищена в природе
4. Как мы можем применить IT-подход в биологии против рака?
4.1 Более надёжное копирование
4.2 Резервная копия
4.3 Избыточность и репарация (биологич. моменты)
4.3.1 Избыточность
4.3.2 Репарация
4.4 Контрольные суммы и коды исправления ошибок
4.5 База данных с сигнатурами опасных мутаций
4.6 Подавление активности мобильных генетических элементов
4.7 Потенциально самое лучшее решение
5. Делаем контрольные суммы для ДНК
5.1 Наивная реализация идеи контрольных сумм
5.2 Возможная биологическая реализация, приближенная к реальности
5.2.1 Биологическая молекулярная реализация счётчика
5.2.2 Примерный подсчёт увеличения надёжности копирования ДНК из-за счётчика
5.3 Способы внедрения в ныне живущих и в эмбрионы
5.4 На чём будем экспериментировать? Выбор модельного организма
5.4.1. Возможный первый шаг — создание немутирующей бактерии
5.5 Идеальный конечный результат — одна прививка, после которой человек не болеет раком.
6. Заключение. Что это даст?
6.1 Увеличение жизни в среднем на 10 лет для заболевших
6.2 Космические путешествия
6.3 Мы берём эволюцию полностью в свои руки. Спонтанные мутации невозможны
1. Что такое рак?
1.1 Это серьёзная проблема человечества
Чувствуете ли вы себя хозяином своего тела? В обычной жизни молодых людей это чувство порой не вызывает сомнений. Но с возрастом его хрупкость всё больше даёт о себе знать. И жизнь и смерть во многом определяются генами. Но не только. Технологии и определяемые ими изменения в обществе уже продлили среднюю продолжительность жизни людей со времён каменного века в разы. И сделали основные причины смерти другими.
Если раньше люди часто умирали от инфекционных заболеваний, то за последние столетия их научились эффективно лечить и основной проблемой стали сердечно-сосудистые заболевания (ССЗ). Но прогресс движется, сейчас и их лечат всё более эффективно и на первое место среди причин смертности, особенно, в развитых странах выходит онкология. И большинство людей почти гарантированно умрут от рака, если полностью убрать ССЗ.
К тому же, болеть онкозаболеваниями, в отличие от многих других болезней, крайне неприятно; они нередко омрачают последние месяцы и годы жизни человека чувством обречённости и нарастанием симптомов.
Таким образом, основные причины смертности людей — это ССЗ и рак. В тех странах, где с ССЗ успешно борются, смертность от рака увеличивается.
Например, в Великобритании 53% смертей после 75 лет происходят от рака. Если же смотреть по всем возрастам, то это 28% (данные 2016 года).
Если говорить о мире в целом, каждый третий мужчина и каждая четвертая женщина на Земле становятся жертвами рака.
По данным Википедии, насчитывается 135 разных видов рака.
По данным Национального Института Рака, таких видов насчитывается 183. Причём в каждом виде могут насчитываться десятки, сотни и тысячи и более его разновидностей, различающихся поврежденными генами.
Почти каждый вид рака требует своего уникального подхода в лечении, своих лекарств. Фармацевтические компании тратят огромные деньги, чтобы найти подход к каждому виду, потому что рак — болезнь смертельная.
На проведение исследований, связанных с раком, уходит, по разным оценкам, до 90% общего финансирования биологических и медицинских наук в мире.
А какой результат? Да, в некоторых случаях рак смогли перевести в хроническую болезнь и человек живёт до тех пор пока в состоянии проходить курсы химиотерапии.
Но люди как умирали от рака, так и умирают. Кто-то может возразить, что “за последние десять-двадцать лет общая онкологическая смертность в различных возрастных группах снижалась на 1% каждый год — и эта тенденция отмечается во всём мире. ”
Это очень мало. Чтобы смертность уменьшилась в 100 раз, нам потребуется 450 лет. 0.01 = 0.99450.
Многие богатые люди так или иначе сталкиваются с раком и потом частным образом учреждают новые фонды борьбы с раком или даже открывают институты.
Это прекрасные начинания. Но вызывает удивление, почему эти люди задумываются об этом только когда припрёт к стенке, а не заранее. Ведь ценнее жизни ничего нет.
Некоторые примеры. В апреле 2016 года Шон Паркер (основатель Napster, Facebook, Spotify) выделил $250 миллионов на создание Parker Institute for Cancer Immunotherapy.
В том же 2016 Майкл Блумберг (бывший мэр Нью-Йорка) пожертвовал вместе с другими 128 миллионов долларов на создание института иммунотерапии рака Блумберга-Киммеля при университете Джона Хопкинса.
Недавно Олег Тиньков заболел раком крови и также создал свой фонд.
Известный факт, что родной сын Джо Байдена умер от рака. Под влиянием этого печального события Байден в 2016 году, когда был вице-президентом при Обаме, участвовал в создании коалиции “Cancer Moonshot” (в названии обыгрывается победа над раком по аналогии с успешно выполненной США задачей доставки человека на Луну).
Далее коалиция была переименована в Cancer Breakthroughs 2020. Байден и администрация Обамы запросили 1 миллиард долларов у конгресса США и получили 1.8 миллиарда на 7 лет, до 2024 года.
Учитывая, что сейчас Байден стал президентом США, мы надеемся, что он помнит об этой инициативе и сможет её дополнительно профинансировать.
Подведём итоги. Вылечить болезнь, имеющую тысячу лиц, не так просто. На уже появившийся рак можно влиять с целью его уничтожения, или, хотя бы, замедления развития, разными способами, и постепенно это удается все лучше. Но слишком медленно.
Итак, рак — это самое серьёзное препятствие на пути к долголетию.
1.2 Определение рака
Рак — заболевание, при котором клетки начинают расти и делиться бесконтрольно вследствие произошедших мутаций (повреждений ДНК, передающихся клеткам-потомкам).
При этом нужно отметить, что в клетке имеются механизмы защиты, ограничивающие способность деления дефектной клетки или даже приводящие ее к апоптозу (запрограммированная клеточная смерть). Поэтому в норме одна единственная мутация редко приводит к раку. Для того, чтобы возник рак, обычно необходимо, чтобы мутации одновременно сняли ограничение на число делений и отключили защитные механизмы самоубийства клетки.
Разумеется, данные поломки можно осуществить множеством различных способов. Что и приводит нас к раку как к чрезвычайно многоликой болезни, при которой каждый конкретный случай уникален (вызван своим уникальным набором мутаций).
Также важно отметить, что “критическая масса” поломок может набираться в течении нескольких поколений.
Подробнее об этом будет сказано ниже, в п 2.1.
1.3 Как лечат рак сегодня?
1.3.1 Старые методы
Ведущим классическим методом лечения рака является хирургическое вмешательство. Если хирургически удалить из организма все раковые клетки без исключения, рак будет излечен полностью (хотя операция может иметь вредные последствия для организма, в частности, удаление части здоровых тканей вместе с опухолью).
Приходится соблюдать компромисс между максимизацией повреждения опухолевых клеток и минимизацией повреждения здоровых тканей, которое происходит в результате практически любого метода лечения.
Также существуют и развиваются другие направления лечения рака, наиболее часто используемые — химиотерапия и лучевая терапия.
Химиотерапия — применение разнообразных лекарственных препаратов для уничтожения раковых клеток. То, что раковые клетки незначительно отличаются от здоровых человеческих клеток, в отличии от, например, клеток бактерий или грибков, осложняет лечение.
Лучевая терапия стала применяться довольно скоро после открытия рентгеновского излучения и радиации на рубеже XIX и XX веков. В ней могут использоваться как электромагнитное излучение (рентгеновское и гамма-излучение), так и электроны, протоны, нейтроны, ионы.
Перечисленные виды терапии могут применяться не только по отдельности, но и в комбинациях.
В качестве комбинированных методов, можно привести нейтронозахватную терапию (в ней эффект оказывают реакции между радиочувствительными медикаментами и нейтронами), фотодинамическую терапию, при которой происходит избирательное разрушение раковых клеток под действием светового или инфракрасного излучения из-за накапливаемых в опухолях светочувствительных веществ.
Вылечить рак иногда удаётся даже полностью, но, как правило, это непросто, поэтому важно принимать профилактические меры, стараясь, чтобы он не возник.
Согласно статье от Всемирной организации здравоохранения (ВОЗ):
В настоящее время можно предотвратить возникновение 30–50% раковых заболеваний, если избегать факторов риска и осуществлять соответствующие стратегии профилактики, основанные на фактических данных.
1.3.2 Недостатки старых методов
Однако, распространенные способы лечения рака имеют серьёзные побочные эффекты.
При химиотерапии и лучевой терапии, которые напоминают ковровые бомбардировки и здоровых и раковых клеток, массово портятся органеллы и ДНК здоровых клеток, что провоцирует повторные раковые опухоли после выздоровления, даже если и удастся его достичь (что непросто, так как нужно уничтожить ВСЕ раковые клетки и при этом не нанести повреждения здоровым клеткам, которые окажутся несовместимыми с жизнью организма).
Хирургические вмешательства сами по себе травматичны и рискованны.
Даже у профилактики есть минусы. Например, гипердиагностика.
Гипердиагностика рака – это обнаружение при скрининге или другом виде медицинского обследования новообразования, которое, имея все признаки злокачественной опухоли, при этом не прогрессирует и не приводит к смерти пациента, либо прогрессирует настолько медленно, что может не проявить себя клинически в течение жизни.
При этом человеку, фактически, необоснованно ставят диагноз «рак», что может самым серьезным образом отразиться на образе и качестве его жизни. К тому же такой диагноз – источник неоправданно высоких показателей выживаемости больных раком предстательной или молочной железы. Источник.
Не исключена даже такая возможность, что лечение ложно диагностированной онкологии старыми методами спровоцирует онкологию настоящую.
Увеличение продолжительности жизни раковых больных за последние 20-30 лет произошло не из-за того, что появились революционные методы терапии, а главным образом потому, что рак начал диагностироваться на более ранней стадии. Источник.
Вдумайтесь в предыдущую цитату. В некоторых случаях больные стали жить дольше после выявления рака только потому, что отсчёт времени их оставшейся жизни начался раньше, так как опухоль нашли раньше. Т.е. по факту в некоторых случаях профилактика иногда добавляет больше беспокойства, чем лечит.
Старые методы либо оттягивают печальный итог, либо несут в себе колоссальные побочные эффекты. Известно, что дети, перенёсшие рак и вылеченные химиотерапией, умирают на десятки лет раньше, чем дети, никогда не болевшие раком. Если в детстве ребёнка вылечили от рака, то он проживёт в среднем 58 лет, на 16 лет меньше (или на 25% меньше), чем люди не болевшие раком в детстве.
Ни один из старых методов не может гарантировать устойчивую ремиссию.
1.3.3 Новые и экспериментальные методы
Их можно разделить на несколько групп. Естественно, эта классификация не претендует на полноту.
- Физические методы
- локальная гипертермия (уничтожение раковых клеток нагревом)
- криоабляция (локальное замораживание)
- лазерная терапия
- воздействие сфокусированным ультразвуком высокой интенсивности
- радиочастотная абляция (РЧА) с использованием токов высокой частоты (450-500 Кгц).
- Нанотехнологии
- деформация раковых клеток изнутри
Деформация раковых клеток изнутри«Ученые из Германии создали совершенно новый способ лечения рака — он направлен на разрушение структуры злокачественных клеток, чтобы запустить процесс их самоуничтожения. Первые доклинические результаты показали многообещающие перспективы будущей терапии — разные культуры раковых клеток уничтожались в среднем за 4 часа. При этом терапия абсолютна безвредна для здоровых клеток.» Источник.
- закупорка сосудов ведущих к опухоли
Закупорка сосудов ведущих к опухоли“В крупном исследовании в области наномедицины ученые Аризонского государственного университета (ASU) в сотрудничестве с исследователями из Национального центра нанонауки и технологии (NCNST) Академии наук Китая успешно запрограммировали нанороботы для сокращения опухолей путем отсечения их от притока крови.» Источник.
- Направленная доставка лекарств в опухоль липосомами или магнитными наночастицами
- деформация раковых клеток изнутри
- Биохимические методы
- блокирование или замедление экспрессии онкогенов
Блокирование экспрессии онкогеновРезультаты исследования, опубликованные в журнале Molecular Cancer Therapeutics (Pecot et al., Therapeutic Silencing of KRAS using Systemically Delivered siRNAs), показали, что использование малых интерферирующих РНК (миРНК) не только резко останавливает рост рака в клетках легкого и толстого кишечника, но и препятствует распространению метастазов. РНК-интерференция имеет большие перспективы в лечении заболеваний печени, вирусных инфекций и рака. Источник. - активация генов-супрессоров (в первую очередь гена p53)
- блокирование сигнальных путей деления и пролиферации клеток
- таргетная терапия (на рецепторы опухолевых клеток)
- пролекарства, активируемые в опухоли
- блокирование или замедление экспрессии онкогенов
- Иммунологические методы
- активация иммунного ответа (ингибиторы контрольных точек, CAR-T, adoptive T-cells, дендритная терапия)
Хорошая статья от Русфонда о методе CAR-T.
Создание новых рецепторов на Т-клеткахЕщё в 2010 году Уильям Людвиг вылечился сразу от трёх видов рака с помощью CAR-T. Зелиг Эшхар (Zelig Eshhar), иммунолог из Вайцмановского института в Израиле в 1989 году изобрёл «химерный рецептор антигенов Т-клеток», CAR-T, описав их, как «Т-тела». Они были созданы из смешанных вирусов, переносящих новый человеческий ген. Вирусы проникали в клетки человека, перенося этот ген. На месте ген создавал на Т-клетках новый рецептор, имитировавший функцию наведения антител, помогая им нацеливаться на раковые клетки”.
Статья в NY Times, научпоп-статья на английском, перевод последней на Хабре.
Научная статья:
Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia
Нобелевская премия в 2018 году за активацию иммунного ответаВ 2018 году получил Нобелевскую премию способ основанный на активации иммунного ответа, предложенный James P. Allison и Tasuko Honjo. Способ пока проверен на нескольких видах рака и только на мышах.
- активация иммунного ответа (ингибиторы контрольных точек, CAR-T, adoptive T-cells, дендритная терапия)
Очень перспективным выглядит метод лечения рака CAR-T. Из организма извлекаются иммунные T-клетки, проходят процесс «обучения» борьбе с опухолями (на них создаются химерные рецепторы-антигены против конкретного вида опухоли) и затем возвращаются в организм.
Перечисленные методы не универсальны, имеют существенные побочные эффекты и далеко не во всех случаях дают гарантии излечения.
1.3.4 Недостатки новых методов
Многие из новых методов очень дорогие, например, CAR-T (~$500K).
На подготовку и применение методов молекулярного уровня (нанороботы, моноклональные антитела) нужно существенное время. Например, для метода CAR-T в мире на текущий момент есть всего 2 завода (в Германии и США), которые могут делать такие T-клетки, а процесс производства занимает около 3 недель. Что не оставляет шанса поздно диагностированным больным на терминальных стадиях, даже если у них есть информация об этом методе и нужная сумма.
Физические методы имеют те же недостатки, что и традиционные. Они действуют на уровне довольно больших опухолей и после лечения возможно возникновение метастазов.
Мало где можно воспользоваться новыми и экспериментальными методами, так как они не успели получить широкого распространения.
Главная проблема новых методов в том, что они не дают полную защиту от рака, а только иногда его могут вылечить.
2. Причины рака
Эпигенетические ошибки приводят к возникновению доброкачественных опухолей, клетки которых по мере накопления мутаций озлокачествляются. Причиной являются повреждения в генах некоторых клеток, снимающие ограничения в количестве и скорости делений.
Необходимо примерно от 10 до 25 «драйверных» (ключевых) мутаций в ключевых генах для запуска процесса озлокачествления (часть из них могут быть наследственными). Далее уже растущая опухоль накапливает несколько тысяч дополнительных мутаций, некоторые из них приводят ко всё более её злокачественному её поведению.
В живом организме постоянно существуют разного рода факторы, которые повреждают структуру ДНК, но клетка устроена таким образом, что подавляющее большинство этих повреждений быстро исправляются (этот процесс называется репарацией), поэтому мы, как правило, доживаем до 40 лет без рака.
Есть различные виды репараций, поскольку существуют различные виды повреждений ДНК. За основополагающий вклад в исследования процессов репараций трое учёных в 2015 году были награждены Нобелевской премией.
Подавляющее большинство из повреждений ДНК оперативно репарируются. Однако, часть из них закрепляется в генотипе, избежав репарации и защитные силы организма больше не воспринимают их как нечто инородное. Их мы называем мутациями.
Происходят мутации по разным причинам. Например, по причинам химических реакций внутри клетки или неточному копированию ДНК при делении клетки. Также могут быть дополнительные мутации при контакте с внешними мутагенными факторами (например, с радиацией, химическими мутагенами).
Они могут происходить в кодирующих (это очень опасно) и некодирующих областях генома. Мутации могут быть нейтральными или даже полезными, но как правило, они ничего хорошего организму не несут. Обычно их последствия определяют жизнедеятельность конкретной клетки (если клетка не делится) или её потомков, если клетка делится. Далеко не все даже вредные мутации приводят к раку. Считается, что каждая клетка в течение жизни человека накапливает около 400 мутаций (так называемые соматические мутации, обычно не приводящие к раку, но нарушающие функционирование).
Если в результате мутаций клетка начинает делиться неконтролируемо, возникают злокачественные опухоли. Таким образом, повреждения в одной клетке могут стать причиной гибели всего организма.
Для того, чтобы управлять геномом в направлении повышения его стабильности, нужно понимать природу накопления неисправленных ошибок в геноме, для чего нужно знать виды повреждений генов и виды репарации, а также причины и количественные оценки точности процесса репарации для различных участков генома. Тем более, что некоторые учёные полагают, что от 80% до 90% всех раковых заболеваний связаны с отсутствием репарации ДНК.
Гены, которые имеют риск стать причиной опухолей после мутаций в них, называются протоонкогенами (после получения приводящей к раку мутации их называют онкогенами).
Мутации в генах-онкосупрессорах (подавителях рака) могут также способствовать развитию рака, если они приведут к нарушению или отключению этих генов. К настоящему времени идентифицировано примерно 300 онкогенов и супрессоров опухолей.
Итак, основной причиной рака являются нарушения в ДНК: в протоонкогенах или в генах-супрессорах.
3. Информационные технологии против рака
Суть рака — это повреждения ДНК, закрепившиеся как мутации. Фактически, рак — это информационная проблема. Борьба с потерями информации породила информатику. Попробуем взглянуть на рак с этой точки зрения и рассмотрим основные методы из мира IT по сохранению информации.
Традиционные медицинские подходы подбирают лечение исходя из конкретной разновидности опухоли, места её возникновения и т.п., однако, сосредоточив усилия и финансовые ресурсы в поисках универсальных информационных механизмов предотвращения рака, вероятно, можно было бы решить проблему рака дешевле, быстрее и эффективнее, чем создавая отдельный способ лечения для каждого частного случая.
Могут ли идеи из мира IT дать что-то новое биологии в помощь в борьбе с раком?
Можно сказать, что в IT-мире информация может теряться или портиться (если не брать в расчёт ошибки человека) в основном из-за несовершенств/поломок линий связи и устройств хранения информации, а также из-за злонамеренных действий вирусов.
3.1 Более надёжное копирование
Переход от аналогового копирования информации к цифровому совершил революцию в деле распространения информации.
Более надёжное копирование получается из-за нескольких компонентов:
- сам двоичный код более помехоусточив, чем аналоговая информация (всего 2 уровня сигнала)
- передача вместе с информацией проверочных кодов
- хранение информации вместе с восстанавливающими кодами
При цифровом копировании информации мы можем использовать кодирование с избыточностью, контрольные суммы, хэши, цифровые подписи, чтобы быть уверенными в том, что копия идеентична оригиналу.
Поэтому, если мы придумаем более совершенный способ копирования ДНК, то значительно уменьшим процент мутаций.
3.2 Резервная копия
В случае катастрофических потерь информации в IT применяются бэкапы. Например, свести последствия пожара в дата-центре к минимуму поможет резервная копия в другом здании.
3.3 Избыточность и репарация in place
Менее значительная потеря информации, например потеря одного диска.
В первую очередь приходят на ум RAID-массивы, которые обладают избыточностью, которая способна компенсировать частичные потери информации.
3.4 Контрольные суммы
В конце каждого сектора на жёстких дисках хранится востанавливающая контрольная сумма, которая способна компенсировать потерю нескольких бит информации.
3.5 База данных с сигнатурами вирусов
Антивирусы с помощью подобных баз данных отличают полезные программы от вредных.
3.6 Удаление спящих вирусов
Очистим диск от неактивных вирусов в файлах. То, что вирус сейчас неактивен, не означает, что он никогда не активизируется или мы по ошибке сами не запустим вредоносную программу.
3.7 Как ДНК защищена в природе
За миллиарды лет эволюции наши клетки приобрели множество механизмов защиты ДНК. Составим табличку в которой запишем аналогии между мерами защиты информации в природе и используемыми в IT.
| Вид потери информации | IT-аналогия | Биологический аналог |
|---|---|---|
| Катастрофическая потеря | Полный бэкап | Соседние клетки-клоны |
| Потеря крупного куска | RAID-массив | Двойной комплект хромосом |
| Потеря среднего куска | Копия нужного файла на том же носителе | Копия гена на этой/другой хромосоме |
| Потеря нескольких бит | ECC-поле в конце секторов жёсткого диска (50 байт для сектора в 512 байт, 100 байт для сектора в 4096 байт). Коды Рида-Соломона. |
Избыточность в кодонах (см. ниже) |
| Битовые потери | ECC-память | Избыточность в кодоне, но не во всех случаях срабатывает. Двойная спираль ДНК, каждое основание дублируется по принципу комплементарности |
Избыточность в кодонах как защита от мутаций
Одним из факторов, уменьшающих скорость накопления изменений в белках, производимых клетками, является то, что кодонов, кодирующих аминокислоты, существует 61, а аминокислот 20-22 (две особые: селеноцистеин и пирролизин). Таким образом, почти все аминокислоты кодируются несколькими кодонами. Исключением является метионин, кодируемый одним кодоном. Возможны такие мутации, когда исходный кодон превращается в новый кодон, но ими обоими кодируется одна и та же аминокислота, а следовательно, такая мутация может приводить к мало значимым изменениям в деятельности клетки (хотя некоторые изменения всё равно имеют место, например, изменения в количестве вырабатываемого белка). Замены кодона, не приводящие к замене кодируемой аминокислоты, называются синонимичными мутациями (заменами). Могут особо ни на что на уровне клетки не повлиять и несинонимичные замены, но считается, что в целом влияние синонимичных замен меньше, чем несинонимичных. Источник.
Для 18 аминокислот существует более одного кодона (от 2 до 6). Источник.
Эволюция постаралась и в ходе неё появились прекрасные механизмы защиты от мутаций. Теперь должны постараться и мы и усилить эту защиту, чтобы победить рак.
4. Как мы можем применить IT-подход в биологии против рака?
4.1 Более надёжное копирование
Вероятность заболеть раком зависит от числа клеток в организме. Поскольку рак может начаться с одной-единственной мутировавшей клетки, то чем больше клеток в организме, тем выше должна быть вероятность рака. Она должна быть прямо пропорциональна его размерам и массе. Но это, как оказалось, не является универсальной закономерностью. В рамках одного вида это работает.
В пределах одного вида ...
В пределах одного биологического вида «закон размеров и возраста» вполне себе работает. Так, известно, что люди более высокого роста страдают раком чаще, у них он протекает более агрессивно и чаще приводит к смерти. Источник.
Между различными видами этот закон уже не выполняется. Взрослые слоны весят в среднем 5-7 тонн, киты могут весить более 100 тонн. При этом, размеры клеток у них мало отличаются от размера человеческих клеток. В теле кита огромное количество генетического материала, масса возможностей для возникновения онкомутаций, что не мешает им жить довольно долго и редко болеть раком.
Люди болеют раком значительно реже, чем мыши. А киты и слоны реже, чем человек.
Отсутствие корреляции между размерами тела, продолжительностью жизни и риском онкологических заболеваний было названо парадоксом Пето (Peto's paradox).
Очевидно, что у больших существ выработались более совершенные онкозащитные механизмы.
Причины устойчивости к раку у китов пока не столь ясны и ряд исследователей предпринимает попытки их выяснения. Доктор Марк Толлис (Marc Tollis) отмечает: “в среднем киты накапливают в своих генах меньше мутаций по сравнению с другими млекопитающими".
Скорее всего, у китов более точно работает процесс копирования ДНК (и/или репарирования ДНК), в частности, фермент, ответственный за это — ДНК-полимераза.
Значит, нужно сравнить ДНК-полимеразу у китов и человека, сделать diff (найти отличия) и пропатчить человеческую ДНК-полимеразу, чтобы она работала столь же хорошо, как и китовая.
4.2 Резервная копия (тут о хромосомах: растения, некоторые экстремофилы)
Между тем, есть данные о том, что репаративные способности организма человека далеки по эффективности от репаративных способностей некоторых других организмов, живущих в агрессивной среде, наполненной факторами, повреждающими геномы.
Такие организмы, способные выживать при существенном отклонении параметров среды обитания от типичных для земной биосферы, называются экстремофилами.
Если даже в обычном хрупком человеческом организме возникают и исправляются десятки тысяч повреждений в сутки в каждой клетке, то организм экстремофила — это арена постоянной борьбы с агрессивной стихией, он больше похож на птицу Феникс, или терминатора из жидкого металла T-1000, которым приписываются способности восстанавливаться после сильных повреждений.
Огромный интерес представляют радиорезистентные организмы. Радиация присутствует в разной степени везде и может наносить различные типы повреждений. И тем не менее, обнаружены организмы, которые и с ней могут справляться намного более эффективно, чем человек. Для человека летальная доза радиации примерно 4-10 Гр, а для археев Thermococcus gammatolerans она оценивается в величину порядка 30000 Гр.
Кроме того, для этих археев не создаёт проблемы температура 100 градусов по Цельсию в гидротермальных источниках. Важную роль в обеспечении их выносливости играют эффективные механизмы репарации.
Ещё один монстр выживания в ядерных реакторах — это бактерия Deinococcus radiodurans, которая способна выживать при дозе до 10000 греев, чья уникальная способность противостоять радиации основана в значительной мере на том, что в клетке есть одновременно несколько полных копий ДНК. У бактерий главный механизм репарации ДНК — это гомологичная рекомбинация. Поэтому, логично предположить, что обладание многочисленными резервными копиями генов даёт возможность Deinococcus radiodurans к более эффективному восстановлению, не говоря о дублировании работы жизненно важных генов.
Растения находятся постоянно под солнцем, которое тоже является источником световой радиации, постоянно повреждающей ДНК. Растения защищают свою ДНК тоже с помощью избыточности, наличия многих копий хромосом, а также с помощью вынесения наиболее уязвимых частей в листья, которые не жалко потерять.
Самый простой способ увеличения избыточности — это многократное дублирование целых хромосом. Самый простой пример — это растения с их полиплоидным набором хромосом. Хотя, возможно, полиплоидность в растениях закрепилась из-за того, что даёт существенные эволюционные преимущества (возможность мутаций на одной из хромосом с последующим выкидыванием хромосом с менее удачной версией гена) возникла для
Возможно, имеет смысл провести эксперименты на млекопитающих по искуственной полиплоидности.
4.3 Избыточность и репарация (биологич. моменты)
С повреждениями ДНК мы можем бороться, либо имея дополнительные копии генов, либо имея некие репарационные системы.
4.3.1 Избыточность
В организме человека избыточность используется на многих уровнях: каждая хромосома дублируется (одна идёт от матери, вторая от отца), важные гены дублируются, и в самой ДНК каждое основание дополнено комплементарным, что позволяет клетке исправлять простые повреждения.
Интересный факт: у женщин две X-хромосомы, а у мужчин всего одна. На этой хромосоме есть онкосупрессорные гены, из-за чего женщины реже болеют раком (кроме некоторых специфично женских вариантов рака). Источник.
У слонов механизм защиты от рака основан на увеличении числа копий критически важных онкосупрессорных (подавляющих рак) генов. Учёные под руководством Джошуа Шиффман (Joshua D. Schiffman) и Карло Мейли (Carlo Maley) из Университета Юты вместе с коллегами из Университета штата Аризона и Пенсильванского университета в своей статье в Journal of the American Medical Association проанализировали статистику смертности слонов и убедились, что они, действительно, устойчивы к раку более многих других видов: всего лишь 5% толстокожих умирают от опухолей, тогда как, к примеру, у гиеновидных собак рак губит 8%, не говоря уже о 11-25% людей (популярный пересказ статьи из JAMA).
Анализ генома показал, что у африканских слонов есть целых 40 копий гена p53, у азиатских – от 30 до 40.
Дело в том, что p53, образно названный «хранителем генома» – известнейший супрессор образования раковых опухолей. Он запрещает клетке делиться, если находит в ней повреждения ДНК, до тех пор, пока клетка их не исправит или не самоуничтожится (самоуничтожение по-научному называется апоптозом).
У человека всего 2 копии гена p53, в которых может произойти мутация, которая повредит ген или этот ген по ошибке может оказаться заметилированным, что приведёт к подавлению его экспрессии (он не будет работать).
Метилирование гена - это ...
Это когда метильные группы прицепляются к промоторной зоне гена, что мешает гену экспрессироваться (синтезировать закодированный им белок). За счёт того, что в каждой клетке человеческого тела активны разные гены из-за разного метилирования, наши клетки так сильно между собой отличаются. Проблема в том, что метилирование/деметилирование генов — это процесс со стохастической компонентой. Чем старше организм, тем больше он нарушается. Нужные гены могут оказаться заметилированными, а ненужные разметилироваться. На этом основаны эпигенетические часы Хорвата.
А вот пациенты-люди с наследственным синдромом Ли-Фраумени в отношении рака почти противоположны слонам. У них всего одна активная копия p53 и риск рака в течение жизни превышает 90 процентов.
4.3.2 Репарация
Теперь о репарации ДНК. Как правило, она происходит за счёт избыточности ДНК. Каждое основание в молекуле ДНК имеет комплементарное, поэтому на основе неповреждённой цепи особые ферменты могут исправлять единичные или даже множественные повреждения, если они приходятся только на одну цепь, за счёт неповреждённой второй цепи.
Если повреждены обе цепи, то участок ДНК копируется с гомологичной хромосомы (хромосомы от другого родителя).
Известны четыре основных типа повреждений в ДНК:
- повреждение одиночных нуклеотидов;
- повреждение пары нуклеотидов;
- разрыв цепей ДНК;
- образование поперечных сшивок между основаниями одной цепи или разных цепей ДНК.
По сути ошибки в репарации происходят так же часто как и в репликации, а при некоторых условиях даже чаще.
В этом нет ничего удивительного, так как, чтобы правильно исправить ошибку, желательно знать, какой должна быть правильная информация. А в случаях серьёзных повреждений дублирующей информации может вообще не остаться.
Это принципиальный недостаток систем репарации, кроме того, при случайной трансформации одного из оснований в другое, некомплементарное, репарационные белки могут найти это несоответствие и превратить основания в комплементарные, но вероятность ошибки при этом будет существенна, хоть и ниже 50%.
Иными словами, точность репарационных систем сильно ограничена.
Если представить, что всю ДНК можно закодировать чем-то типа кодов Рида-Соломона, то это может принципиально улучшить процессы репарации ДНК, но для того, чтобы вся существующая биомашинерия продолжала работать, придётся создать массу новых белков (и генов) ответственных за экспрессию, транскрипцию и другие биологические процессы. Это архисложная задача на текущий момент, хотя и несёт в себе колоссальный потенциал.
Согласно имеющимся оценкам, в каждой клетке человеческого тела в час происходит от 100 до 1000 событий повреждения ДНК .
Обычным повреждением является спонтанное отщепление оснований, достигающее десятки тысяч событий на клетку человека в сутки. И только за счёт различных репарирующих механизмов (например, эксцизионной репарации) геном человека не превращается в бессмысленную кашу.
Частота повреждений сильно зависит от внешних условий, даже стрессы и переживания могут служить причиной их появления. При любом сценарии остаётся и накапливается некоторое количество неисправленных повреждений (в случае их передачи последующим поколениям они называются мутациями и посредством закрепления некоторых из них в популяции обеспечивают эволюционный процесс).
Даже для человека эффективность репарации повреждений удивительно велика. Но поскольку люди состоят из огромного числа клеток и живут очень долго в масштабах скоростей химических реакций организма, даже очень малый остаток неотрепарированных повреждений успевает накопиться, внося к концу жизни среднего человека существенный вклад и в процессы старения, и в риски онкологии.
4.4 Контрольные суммы и коды исправления ошибок
В природе пока не обнаружено контрольных сумм и кодов исправления ошибок в ДНК. Но это не значит, что мы не можем это изобрести и внедрить в геном.
В какой-то мере процесс копирования ДНК в процессе деления клетки можно назвать аналоговым, так как вероятность ошибки при копировании методами, изобретёнными эволюцией, составляет ~10-9. Это примерно 1 ошибка на миллиард скопированных оснований.
Казалось бы, что это крайне мало, но, учитывая огромное число клеток в человеческом теле (около 30 триллионов) и огромное количество делений, которые проходят все клетки за всю свою жизнь, это часто приводит к раку.
Представим, что мы смогли добиться точности копирования, подобной той, что принята в цифровых технологиях. В мире IT это достигается тем, что на каждый сектор данных, который хранится в накопителе, есть определённое число битов чек-сумм, что позволяет снизить вероятность ошибки чтения или записи бита до 10-17 для SSD, например.
При обычном чтении информации с HDD возникают миллиарды ошибок (посмотрите SMART накопителей Seagate, там это хорошо видно), но они исправляются на лету с помощью специальных восстанавливающих контрольных сумм.
Если же удастся внедрить механизмы сверки контрольных сумм в процессы копирования ДНК, мы сможем улучшить точность на несколько порядков, что нанесёт сильный удар по раку.
В теории можно создать организм де-ново, в ДНК-которого будут внедрены коды Рида-Соломона. Но для этого придётся переделывать всю молекулярную клеточную машинерию.
Выглядит так, что сделать контрольные суммы, которые хранятся за пределами генов гораздо проще, чем переделать все гены так, чтобы каждый их блок фиксированный длины был защищён помехоустойчивым кодом, так как для этого не нужно переделывать большую часть машинерии клетки.
4.5 База данных с сигнатурами опасных мутаций
Внедрим в каждую клетку антивирус.
Несколько тысяч мутаций в 300 идентифицированных онкогенов (и в каком-то количестве неидентифицированных) могут быть ответственны за большую часть всех случаев рака (прежде всего, рассматриваем “драйверные мутации”). Внедрив в клетки “антивирусную базу” на такие мутации (на основе CRISPR или micro-RNA), удастся предотвратить большинство случаев рака. База будет работать путём уничтожения мутантных белков (на стадии синтеза РНК) либо путём уничтожения клеток, несущих запрещённые мутации.
4.6 Подавление активности мобильных генетических элементов
Мобильные генетические элементы являются одной из наиболее частых причин мутаций (инсерций, делеций и хромосомных перестроек). При некоторых видах рака наблюдается т.н. микросателлитная нестабильность — повышенная активность мобильных генетических элементов, ведущая к ускорению скорости мутирования на несколько порядков. В здоровых клетках активность мобильных элементов сильно подавлена. Можно либо добавить дополнительные механизмы подавления активности мобильных генетических элементов, либо устранить их вовсе.
На свиньях это получилось
На свиньях было испытано полное удаление одного из видов мобильных генетических элементов — ретровируса PERV, который является наиболее частым транспозоном в геноме свиней. Источник.
4.7 Потенциально самое лучшее решение
Итак, какой же подход лучший для защиты организма от рака? Иметь более точное копирование, много копий хромосом, дополнительные копии важных генов, хорошие механизмы репарации, избыточность в ДНК, контрольные суммы?
Более точное копирование ДНК, как у китов, позволит снизить частоту возникновения рака. Возможно, что пропатчить человеческую ДНК-полимеразу, чтобы она стала более точной, более китовой — это самый простой способ добиться значительных результатов, так как не исключено, что гены ДНК-полимеразы китов отличаются совсем незначительно от человеческих и пропатчить их несложно.
Но это всё равно не исключает рака, так как если онкогенные мутации возникли, то они будут очень точно копироваться и распространяться.
Дополнительные копии хромосом в теории могут уменьшить риск рецессивных генетических заболеваний, так как для развития болезней, ассоциированных с рецессивными мутациями, требуется, чтобы абсолютно все копии гена были мутантными. При условии, что эти новые хромосомы будут спроектированы так, что не будут вызывать пороков развития и плохих побочных эффектов.
Все упомянутые подходы увеличивают стабильность генома, но контрольные суммы позволяют поднять на принципиально новый уровень точность копирования.
5. Делаем контрольные суммы для ДНК
5.1 Наивная реализация идеи контрольных сумм
Попробуем описать суть предлагаемой идеи самым простым способом. Наибольшая угроза возникает, когда
В случае несовпадения контрольных сумм будет запускаться каскад апоптоза (самоуничтожения) клетки.
Апоптоз — это процесс правильного самоуничтожения клетки, при котором она корректно разбирается на кирпичики, которые организм потом может использовать, в отличие от некроза, когда при умирании клетка может нанести урон окружающим тканям и организму.
Этот подход очень напоминает подход языка Erlang, в котором если с процессом что-то не то, то проще его убить, чем пытаться исправить.
Наибольшее количество различных мутаций, согласно приведённым выше источникам, возникает при копировании ДНК. Но даже если это и не так, и большая часть мутаций возникает из-за окислительных реакций, то нам всё равно не нужны эти ошибки в клетках-потомках.
Чтобы подсчитанные контрольные суммы не испортили работу генов, они должны находиться в «безопасных» областях ДНК. Будем понимать под геном участок ДНК между промоторным участком (промотор или pro) и терминаторным участком (терминатор, ter), с которого копируется информационная РНК (и с неё затем синтезируется 1 или несколько белков). Контрольными суммами будем защищать каждый участок от промотора до терминатора, и записывать контрольную сумму для защищаемой области на ДНК после терминатора.
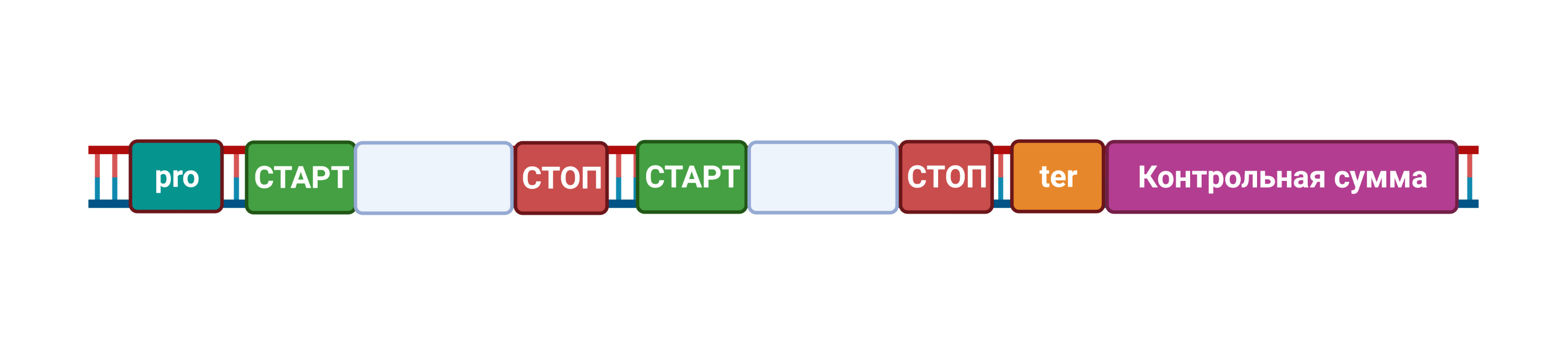
Рис. 1. Простейший вариант контрольной суммы
Всего у человека около 30 000 генов белок-кодирующих генов.
Перед делением клетки специальный фермент хеликаза расплетает двойную спираль ДНК на 2 одинарных спирали, после чего две ДНК-полимеразы достраивают одинарные цепи по принципу комплементарности.
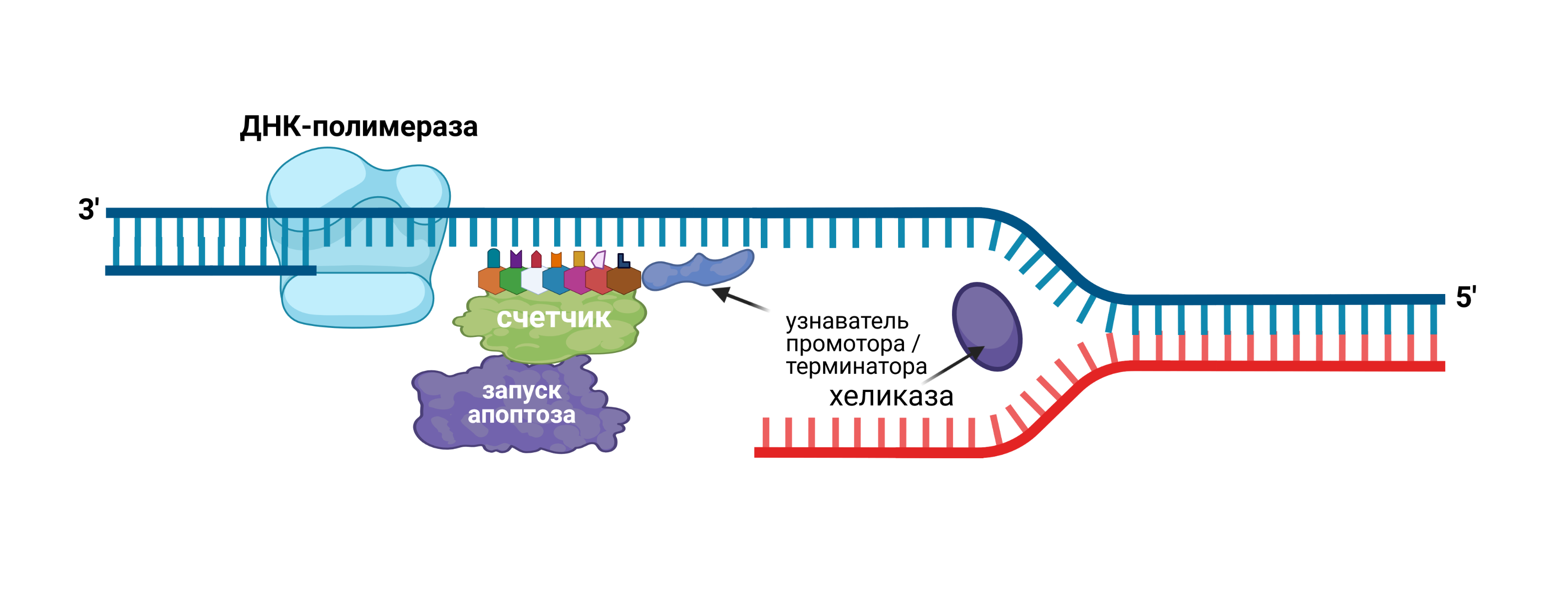
Рис. 2. Механизм работы контрольной суммы во время деления клетки
Наиболее логичным выглядит пропатчить ДНК-полимеразу, чтобы она умела:
- считать контрольные суммы,
- узнавать терминаторы,
- сверять подсчитанные контрольные суммы с записанными
- запускать сигнал апоптоза, если контрольные суммы не совпадают.
Если контрольные суммы отличаются, то копирование прекращается и вызывается апоптоз клетки. Или вначале вызывается апоптоз и копирование прекращается автоматически.
Конечно, не факт, что получится именно так пропатчить ДНК-полимеразу, но решим, что в разделе “наивная реализация” такой патч возможен.
Также возможен вариант сразу же после ДНК-полимеразы запустить новый специальный белок, который будет проверять контрольные суммы.
Как видно, стоит несколько задач:
- Разработать биологическую молекулярную реализацию счётчиков для подсчёта контрольных сумм.
- Подписать контрольными суммами наиболее важные гены или кластеры генов. Для этого нам потребуется после подсчёта сумм их внедрение в ДНК.
- Создать механизм контроля целостности генов с помощью ранее внедрённых контрольных сумм.
5.2 Возможная биологическая реализация, приближенная к реальности
Наивный подход, описанный выше, недостаточно учитывает структуру последовательностей ДНК, сложность механизмов, обеспечивающих её работу, и ограничения существующих методов, поэтому в этом пункте мы рассмотрим более близкую к реальности потенциальную реализацию механизма контрольных сумм.
Предупреждение: дальше будет много сложных слов и картинок, которые описывают возможную биологическую реализацию с учётом различных нюансов. Если вы далеки от молекулярной биологии, то это можно и не понять. Для понимания сути статьи достаточно и наивной реализации из пункта 5.1.
Для функционирования важны не только гены, но и межгенные промежутки, которые обеспечивают пространственную структуру хромосомы и содержат регуляторные участки (энхансеры, промоторы, терминаторы, репрессоры, инсуляторы) и также нуждаются в защите. С другой стороны, внесение дополнительных фрагментов в ДНК (записи контрольных сумм и участки служебной информации рядом с ними) может нарушить работоспособность участка ДНК, в который эти фрагменты вносятся. Таким образом, защищать каждый ген окажется и недостаточно, и небезопасно.
Чтобы защитить важные области и ничего не поломать, можно использовать несколько подходов:
- подписывать лишь отдельные особо важные гены, повреждение которых может привести к перерождению клетки в раковую, при этом для каждого из этих генов необходимо выбрать свой безопасный участок, куда информация вносится.
- найти места в ДНК, внесение подписи в которые не нарушает её функционирование, и подписывать участки между этими местами.
Рассмотрим более подробно второй вариант. На наше счастье, в ДНК существуют места, манипуляции с которыми в большинстве случаев безопасны. Это так называемые “горячие точки рекомбинации” (recombination hotspots) — особые места в ДНК, в которые вносятся разрывы во время кроссинговера (обмена участками между материнской и отцовской хромосомами при мейотическом делении клеток).
Эти точки содержат узнаваемые последовательности и встречаются достаточно часто — примерно 1 точка на 100 тысяч нуклеотидов.
Мы можем обнаружить такие последовательности с помощью специальных белков, разрезать их и добавить защитный участок. Этот участок будет содержать:
- 7 нуклеотидов “подписи” для лидирующей цепи
- метку на ДНК — участок, показывающий, что перед ним стоит подпись (с этим участком у нас будет связываться специальный белок — обозначим его как MARK) длиной около 20 нуклеотидов
- небольшой произвольный участок ДНК в качестве разделителя
- новую горячую точку рекомбинации взамен утраченной — для сохранения способности к рекомбинации в этом сайте
- опять небольшой произвольный участок ДНК в качестве разделителя
- участок MARK и “подпись” для встречной цепи
Проверка КС будет осуществляться на участке ДНК от белка MARK, связанного на лидирующей цепи, до следующего связанного в той же ориентации.
По краям вставленной последовательности сохранятся две половинки уже нефункциональной старой горячей точки рекомбинации. Аналогично проверка будет производиться и на встречной цепи. (см. схему на рисунке ниже).

Рис. 3. Вставляемый участок и расположение контрольной суммы на ДНК
5.2.1 Биологическая молекулярная реализация счётчика
Для создания механизма контрольных сумм нам придётся 1) радикально модифицировать геном 2) разработать дизайнерскую белковую машинерию (Protein design).
Белки с новыми функциями разрабатываются давно (абзимы и химерные белки, такие как этанерцепт), но пока методики относительно грубы, малоэффективны, время- и финансово затратные. Однако разработка эффективных алгоритмов фолдинга белка (AlphaFold) может дать серьёзный толчок в этом направлении. Кроме того, если в ближайшее время создадут мощный квантовый компьютер, то прогресс в этом направлении ещё более усилится.
Эффективность существующих методов редактирования генома пока недостаточна для реализации механизма контрольных сумм, но они также бурно развиваются. Ниже приведём один из возможных путей реализации.
Итак, прежде всего, нам нужен белок, который будет отмечать расположение КС. Назовём его MARK. Он должен выполнять следующие функции:
- связываться со специальным участком ДНК после КС;
- сохранять запись о проверке КС (1 = «КС при последней проверке совпала», 0 = «КС при последней проверке не совпала»).
Запись может быть выполнена путём фосфорилирования самого белка MARK (про фосфорилирование см. ниже).
Затем, нам необходим комплекс из 2 типов белковых молекул — для распознавания нуклеотидов в ДНК и для осуществления работы счётчика.
Для создания счётчика мы можем использовать белок с определёнными областями, которые могут менять своё состояние. Назовём этот белок CS. В живых организмах для функционирования сигнальных путей чаще всего используются метки на белках в виде остатка фосфорной кислоты. В зависимости от состояния, участок белка (сайт) может быть фосфорилирован или нет. Как видно, к белку присоединен или остаток -OH, или -PO42-, что может быть использовано как битовый счётчик.
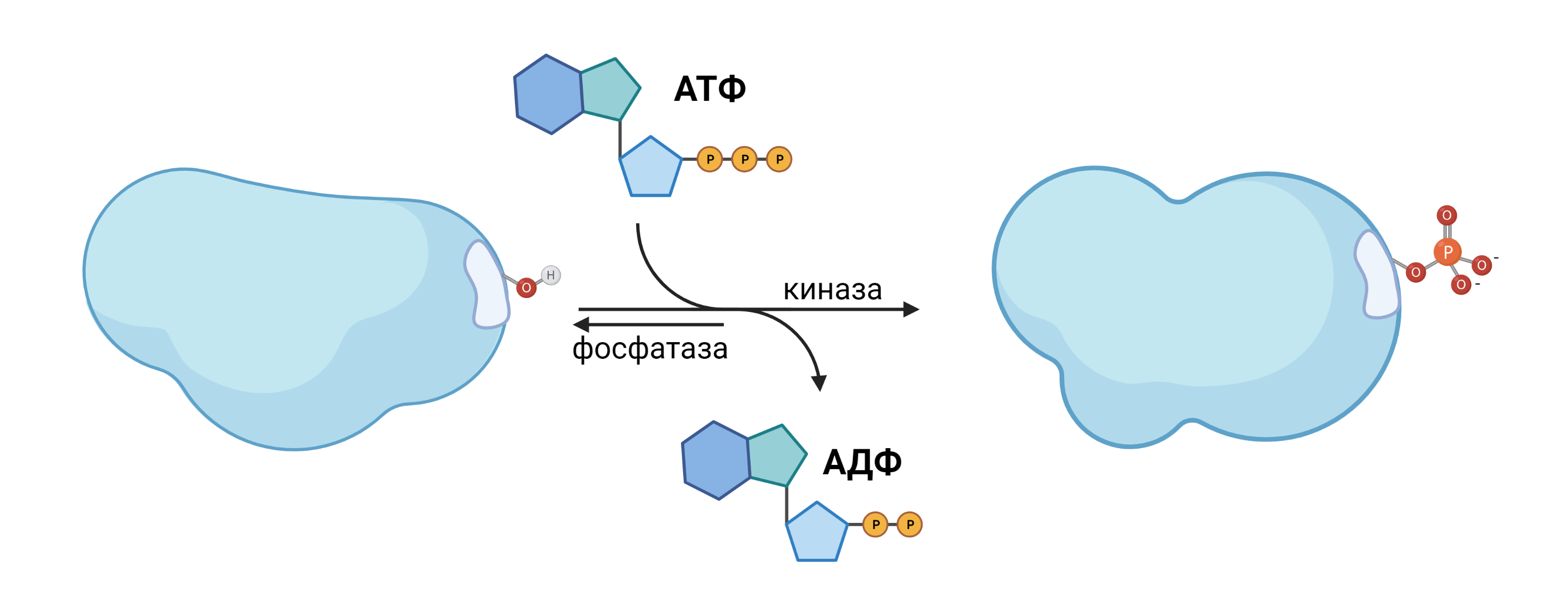
Рис. 4. Фосфорилирование белка
На основе механики нетрудно создать двоичные счётчики.

Нет никаких принципиальных причин, которые запрещают сделать подобный счётчик на молекулярной основе.
Например, мы можем сделать 7 однобитных счётчиков и записывать их результаты как контрольную сумму.
Мы можем считать в подписанном фрагменте чётность:
1. числа аденинов (A)
2. числа гуанинов (G)
3. числа цитозинов (С)
4. числа тиминов (T)
5. числа аденинов + гуанинов (A+G или R, пуриновые основания)
6. числа цитозинов + тиминов (C+T или Y, пиримидиновые основания)
7. общего числа нуклеотидов (ANY или N).
Применив 7 битовых счётчиков, мы получим частичное дублирование некоторых из них, увеличивающее надёжность подсчёта.

Рис. 5. Счетчик открывает доступ к сайту фосфорилирования, соединившись с подходящим ему нуклеотидом
Для распознавания нуклеотидов в ДНК можно использовать белки из семейства TALE. TALE — белки, связывающиеся с двухцепочечной ДНК и узнающие отдельные нуклеотиды. На рисунке выше белки TALE представлены как разноцветные шестиугольники, на которыми расположены карманы для хранения фосфатных связей, который работают как однобитовые счётчики. На правой части рисунка TALE под буквами G, R, N сместились вниз, так как они узнали соответствующие нуклеотиды.
Удобными свойствами TALE является то, что:
- субъединица TALE умеет узнавать нуклеотид;
- TALE связывается с широкой бороздой на поверхности ДНК, т. е. его связывание не требует расплетания двойной цепи ДНК, и, следовательно, не зависит от фазы клеточного цикла и других белков.
Узнавание (как и все прочие функции, осуществляемые белками) происходит за счёт изменения конформации (формы) белковой молекулы.
CS в комплексе с 7 белками TALE должен осуществлять следующие функции:
- связываться с ДНК после белка MARK;
- считывать контрольные суммы, при этом выполнять роль логического инвертора и тактового генератора;
- останавливаться перед следующим MARK, сверять считанные контрольные суммы с последовательностью. на которой он остановился (на деле — эта последовательность должна быть таковой, чтобы после её считывания все счётчики обнулились);
- отсоединяться от ДНК, если счётчики обнулились.
Считывание контрольной суммы осуществляется следующим образом:
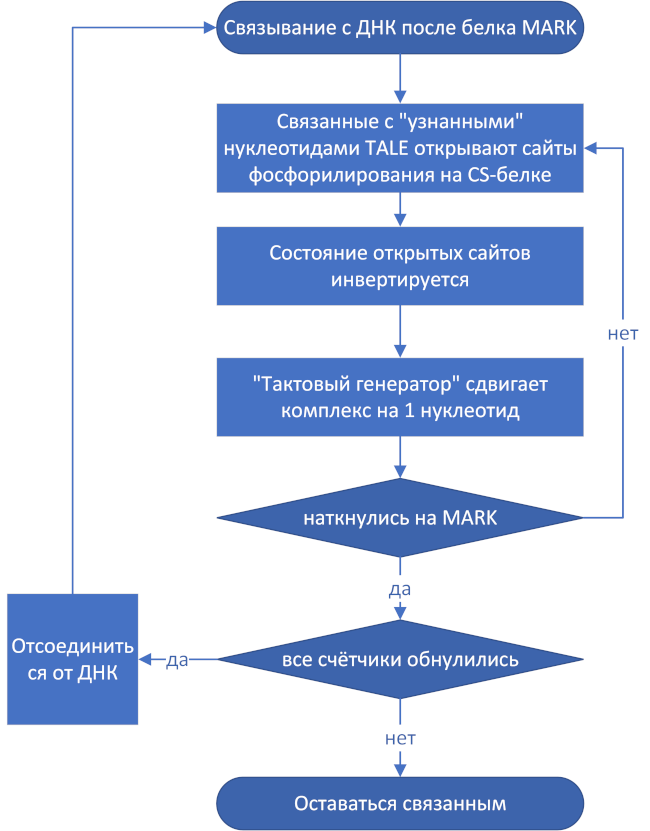
Схема 1. Алгоритм работы контрольной суммы
Комплекс CS, заблокированный в связанном состоянии перед белком MARK, будет свидетельствовать о неправильно считанной контрольной сумме.
Для функционирования системы, кроме, собственно, счётчика, нужна система распознавания несовпадающей контрольной суммы и система ответа. Возможный механизм счётчика описан ранее. Несовпадение контрольной суммы, в таком случае, будет выражаться в «залипших» на ДНК перед сайтами MARK комплексах CS-TALE. Некоторый белок (назовём его SETUP) должен узнавать такие события, активироваться и осуществлять реагирование на них.
Некоторое количество несовпадений в контрольной сумме могут возникать не из-за мутаций, а при неправильной работе самого счётчика. Ввиду некоторой вырожденности счётчика (при мутациях обычно меняется 2 или более бита контрольной суммы) мы можем позволить пропускать некоторое количество ошибок, незначительно снижая его надёжность (позволить 1 биту контрольной суммы не совпадать). Дополнительно мы можем интегрировать состояние счётчика по времени (например, считать, что несовпадение КС вызвано мутацией, если КС не совпадает в более чем половине поыток их прочитать, в противном случае считать несовпадения результатом ошибки счётчика). Таким образом, можно уменьшить вероятность ложных срабатываний. Этим также должен заниматься белок SETUP.
Реагирование на мутацию может осуществляться несколькими способами. Самое простое — уничтожать все клетки даже с одиночными мутациями, вызывая процесс апоптоза. Такой путь надёжен, но расточителен. Второй вариант — переводить клетку в неделяящееся (т. н. «сенесцентное» «ссылка») состояние. Такой путь более опасен, так как обилие сенесцентных клеток вредно для организма, и сохраняется небольшая вероятность спонтанного обратного перехода. Последний вариант — запуск репарации участка путём гомологичной рекомбинации, и при её неэффективности — апоптоз. Все три пути белок SETUP может осуществлять путём запуска существующих внутриклеточных путей.
Участок с контрольными суммами надо внедрить в каждую горячую точку рекомбинации, а дополнительные гены для синтеза белков CS-TALE, MARKER и SETUP — один раз на геном.
Если подписаны не все гены ...
В случае, если внести модификации удастся, скажем, лишь в 80% клеток, это уменьшит вероятность рака в 5 раз. Аналогично — для случая, когда подпишется только 80% участков генома в каждой клетке. Считаем, что в среднем у представителей одного и того же живого вида вероятность развития рака прямо пропорциональна числу клеток.
Если родится ребёнок у модифицированного и обычного человека ...
При подобной реализации контрольных сумм возможны дети между модифицированными людьми и обычными.
Мы вносим новые «горячие точки рекомбинации» взамен разрушенных при встройке участков, поэтому возможность обмена участками хромосом и нормального прохождения мейоза у модифицированных людей (и возможность иметь детей) сохраняется. Также сохраняется возможность рекомбинации между модифицированными и немодифицированными участками хромосом.
У потомства обычных людей и генно-модифицированных из каждой пары гомологичных хромосом будет защищена лишь одна. Однако в этом случае защита будет значительно выше 50%, так как обычно мутации, приводящие к патологиям — это мутации «потери функции», и для развития патологии нужно сломать обе копии гена на отцовской и на материнской хромосоме.
Мы вносим новые «горячие точки рекомбинации» взамен разрушенных при встройке участков, поэтому возможность обмена участками хромосом и нормального прохождения мейоза у модифицированных людей (и возможность иметь детей) сохраняется. Также сохраняется возможность рекомбинации между модифицированными и немодифицированными участками хромосом.
У потомства обычных людей и генно-модифицированных из каждой пары гомологичных хромосом будет защищена лишь одна. Однако в этом случае защита будет значительно выше 50%, так как обычно мутации, приводящие к патологиям — это мутации «потери функции», и для развития патологии нужно сломать обе копии гена на отцовской и на материнской хромосоме.
5.2.2 Примерный подсчёт увеличения надёжности копирования ДНК из-за счётчика
Например, рассмотрим самый неблагоприятный случай, в котором меняется минимальное число бит у счётчика. Какая-то активная молекула изменила цитозин в тимин. Изменятся счётчики цитозина (3), тимина (4). Счётчик цитозин + тимин (6) останется прежним. Изменятся 2 бита счётчика контрольной суммы.
Давайте подсчитаем, во сколько раз будет меньше мутаций, если мы внедрим контрольные суммы.
Рассмотрим одиночные точечные мутации. Они всегда меняют счётчик, поэтому от них абсолютная защита.
Если же говорить о случаях инсерций, делеций и транслокаций произвольной длины, то только каждая 128-я (27) мутация будет сохранять контрольную сумму из 7 бит неизменной.
Подведя черту, можно сказать, что вероятность прохождения одного события мутации через контрольную сумму будет не выше, чем 2-7.
Строго говоря, не совсем ...
При двух одиночных мутациях комплементарных нуклетотидов, например (A-<T) и (T->A) контрольная сумма не изменится. Также как и при подобных четверных мутациях. Во всем множестве мутаций меняющих контрольную сумму будет некоторое число двойных, существенно меньшее четверных, и экспоненциально меньшее число восьмерных и так далее. Точному подсчёту степени защиты ДНК подобным счётчиком можно посвятить отдельную объёмную статью.
Допустим, произошла одиночная мутация, трансверсия, замена аденина на тимин. Изменятся счётчики аденина (1), тимина (4), аденинов + гуанин (5), тимин + цитозин (6). Изменятся 4 бита счётчика контрольных сумм.
Контрольные суммы не совпали и запускается каскад апоптоза.
5.3 Способы внедрения в ныне живущих и в эмбрионы
На данный момент существует несколько способов направленной генной модификации, пригодных для работы с человеческим организмом.
Для целей внедрения контрольных сумм способ модификации должен включать:
- метод доставки генного материала и инструментария в клетку,
- метод собственно изменения последовательности генома.
Если материал доставляется в эмбрион, то на метод доставки налагается минимум ограничений — его можно отправить туда в оболочке из вируса или фосфолипидной наночастицы, вколоть в клетку специальным шприцем, нанести на наночастицу золота, которой затем пробить мембрану клетки, словом, простор для фантазии огромный.
В идеальном случае, следовало бы собрать геном человека заново ещё до его рождения, убрав ошибки и вставив нужные защитные фрагменты. Такая задача сейчас теоретически осуществима лишь с затратой неограниченных средств, но вскоре может стать более доступной.
Для ребенка или взрослого человека от всего этого разнообразия остается в основном вирусный метод доставки, который на данный момент не обеспечивает 100% охвата клеток тела. Однако, само по себе это не является препятствием, т.к. модификация, скажем, 80% клеток вирусным вектором, включающим функционал контрольных сумм, уменьшит вероятность рака в 5 раз.
В терапии уже применяются узконаправленные методы редактирования, основанные на различных белках, разрезающих конкретные участки ДНК, такие как нуклеазы с цинковыми пальцами (ZFN) и нуклеазы TALEN. Последний же и наиболее популярный метод редактирования — это CRISPR/Cas9, обнаруженный несколько десятилетий назад как механизм иммунитета у бактерий.
CRISPR/Cas9 — белково-нуклеиновый комплекс, состоящий из направляющей молекулы РНК, которая способствует распознаванию конкретного участка кода, который нужно модифицировать, и белка, который производит в ДНК разрыв сразу по двум цепочкам.
Наиболее известный случай применения этого метода — это нашумевшая в 2018 году история с созданием устойчивых к ВИЧ ГМ-бизнецов Лулы и Наны в Китае, закончившаяся для их создателя Хэ Цзянкуя тюремным заключением.
Вирусные вектора уже применяются для генной модификации человека: так, в 2015 году директор компании BioViva Элизабет Пэрриш ввела себе экспериментальный вектор на основе AAV (аденоассоциированного вируса), содержавший гены, кодирующие каталитическую субъединицу теломеразы — белка, отвечающего за удлинение кончиков хромосом после деления клетки и фоллистатин — белок, способствующий росту мышц.
Для цели увеличения стабильности генетического кода можно ограничиться лишь модификацией быстро делящихся клеток, либо каким-то образом отключать функционирование системы в неделящихся клетках или вообще во время вне деления, например привязать ее функционирование к делению клетки (например, к функционированию ДНК-зависимой ДНК-полимеразы или состоянию хромосомы при делении).
Как встроить такую систему во взрослый организм? Можно использовать двойной вектор для генотерапии и идти в три стадии:
- встройка участков по hotspots (при этом изначально КС на встроенном участке заполнен “нулями”), встройка генов белковой машинерии КС (SETUP, CS-TALE, MARKER) (1 копия на геном)
- режим записи КС
- режим защиты КС

Рис. 6. Интеграция участка с контрольными суммами.
Наш генотерапевтический вектор будет состоять из 4-х логических частей:
- участок, обеспечивающий размножение этого вектора и поддержание его наличия в клетке. Этот участок будет блокироваться после успешной записи КС и начала их работы.
- интегрируемый участок 1 — участок, который может многократно внедряться в геном (в каждый recombination hotspot) за счёт рнк-зависимой интеграции (аналогично ретротранспазонам).
Содержит 2 участка контрольных сумм, заполненных нулями (для прямой и встречной цепи), сайты связывания MARKER и новый hotspot. КС изначально заполнен нулями, это означает что в ней содержится произвольная последовательность нуклеотидов, например у нас 7 GC-пар. Такие участки будут распознаны как неправильная контрольная сумма.
Генетическая модификация с помощью транспозоновУ большинства организмов в геноме содержится большое число вирусоподобных
фрагментов — транспозонов. Классический транспозон содержит всего один ген — белка транспозазы, а на концах содержит особые позиции — сайты транспозиции.
Можно использовать изменённые белки транспозазы (используется в транспозонах) или интегразы (используется в вирусе ВИЧ) для внедрения контрольных сумм. Эти белки умеют резать ДНК и вставлять большие куски генетического кода.
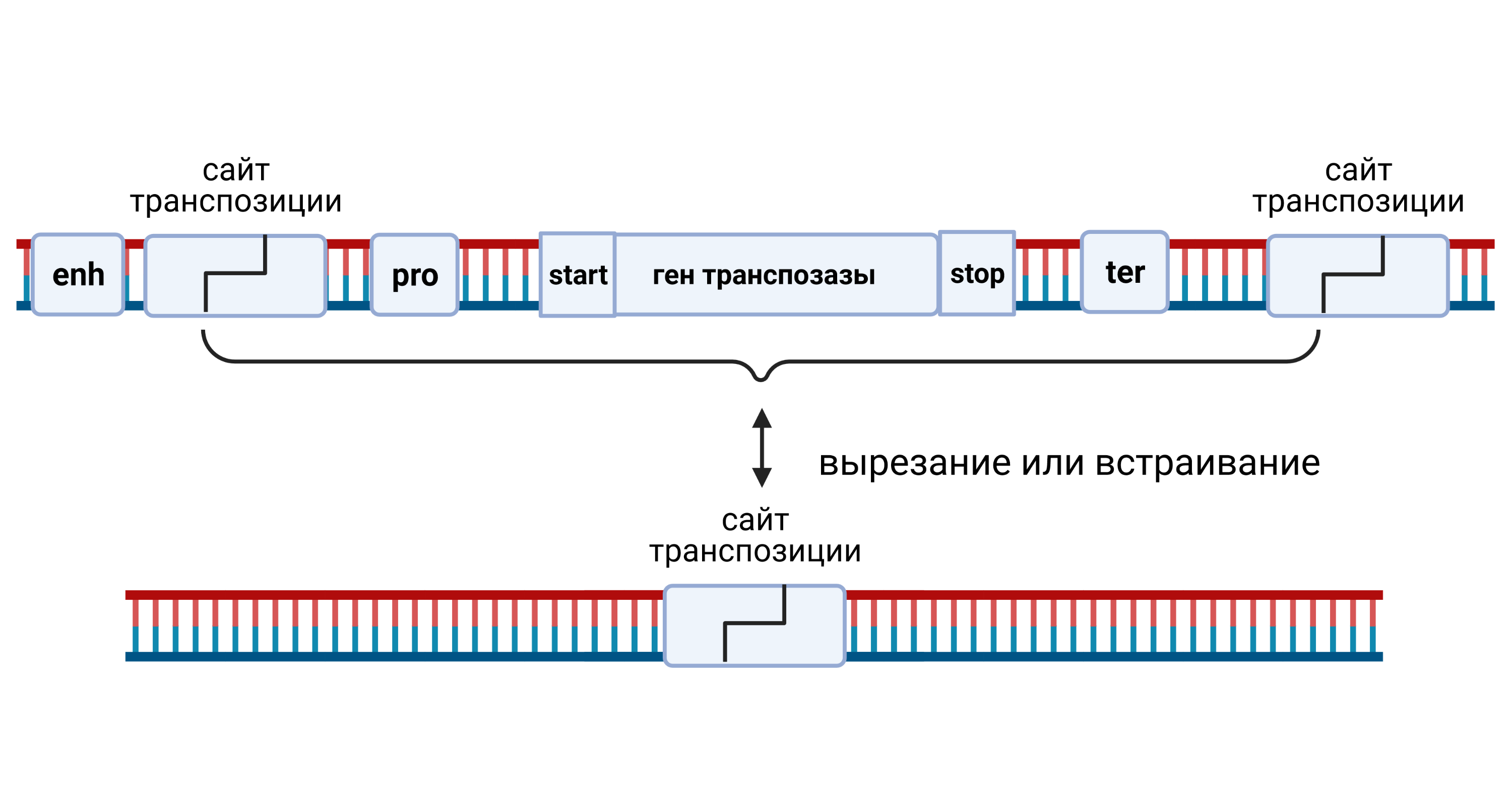
Рис. 7. Логика работы транспозиции фрагментов ДНК.
Транспозаза умеет обнаруживать такие сайты и вносить в них разрыв ДНК или, наоборот, сшивать. Таким образом, транспозон может перемещаться между характерными сайтами в пределах ДНК (для каждого типа транспозонов сайты специфические, возникают в ДНК случайно или сохраняются на месте вставок/вырезаний транспозонов). Действующие по тому же принципу, но чуть более сложным образом ретротранспозоны (копирование РНК всего транспозона -> обратная транскрипция -> вставка в специфический сайт на ДНК за счет транспозазы (интегразы)) копируют, а не перемещают свою ДНК.
Мы можем взять часть машинерии как на основе одного, так и на основе другого механизма, использовав вместо сайта транспозиции последовательность hotspot (потребуется создать интегразу с измененной специфичностью), и ввести на вектор для трансформации клеток необходимый нам участок ДНК между сайтами, аналогичными hotspot’ам. - интегрируемый участок 2 — участок, интегрируемый в геном только один раз, аналогично простым транспозонам содержит кассету генов белков, обеспечивающих работу контрольных сумм (гены белков CS-TALE, MARKER, SETUP).
- Белок — кодирующий участок на векторе, который обеспечивает работу самого вектора на этапе вставки участков в ДНК и записи контрольных сумм. Содержит необходимые для интеграции участков 1 и 2 гены и гены, обеспечивающие логический переключатель между режимами записи КС и проверки КС. Обозначим белок, необходимый для работы переключателя, как SWITCH, и белок, необходимый для записи контрольных сумм, как WRITE.

Рис. 8. Работа комплекса проверки контрольных сумм.
Логика работы вектора следующая:
- С вектора экспрессируются все белки, которые на нём закодированы (в том числе SWITCH и WRITE).
- Интегрируемый участок 2 встраивается в геном и с него начинается синтез белков CS-TALE, MARKER, SETUP
- Интегрируемый участок 1 начинает многократно встраиваться в геном
- CS-TALE прочитывает подписанные участки, определяет контрольные суммы как несовпадающие и вызывает активацию белка SETUP
- SWITCH связывается с активированным беклом SETUP и мешает ему запустить апоптоз клетки.
- Белок WRITE обнаруживает залипшие на несовпадающих КС комплексы CS-TALE и правит КС на совпадающие
- комплекс SWITCH-SETUP вызывает репликацию вектора, обеспечивая поддержание его в клетке.
- как только концентрация комплекса SWITCH-SETUP падает ниже некоторого (близкого к нулю) уровня, что сигнализирует о подписывании правильными КС большинства участков, вектор перестаёт реплицироваться и через некоторое время теряется. Белок SWITCH перестаёт производиться, и через некоторое время (за которое остаток SWITCH деградирует, а WRITE подпишет оставшееся небольшле количество несовпадающих КС и также деградирует) система переходит в режим проверки контрольных сумм.
5.4 На чём будем экспериментировать? Выбор модельного организма
5.4.1. Возможный первый шаг — создание немутирующей бактерии
Чтобы подойти к такой амбициозной цели, как создание генно-модифицированного cancer-proof человека in vivo, нам необходимо получить proof of concept (доказательство, что это в принципе возможно). Для этого нам понадобятся модельные организмы.
Самыми простыми модельными объектами могли бы стать бактерии, или, например, митохондрии.
Создание принципиально немутирующего штамма бактерий может стать ближайшей практической и весьма экономически выгодной целью на пути разработки контрольных сумм для ДНК.
Типичный страх в области генной инженерии бактерий вызывает гипотетическая ситуация, когда ГМО бактерия, созданная, например, для очистки залива от нефти, мутирует и начинает вытеснять природные виды, которые не могут к ней приспособиться, после чего наступает крах биосферы.
Если же бактерия принципиально не может размножаться, если в ней появились мутации, то она не сможет стать эволюционно успешной, так как рано или поздно природные виды уничтожат ее полностью.
Для опытов идеально подошли бы бактерии с полностью искусственно синтезированными ДНК. Это вполне возможно.
Эксперименты над такими бактериями имеют несколько преимуществ:
- Все искуственные бактерии будут полностью идентичны, как специальные чистые линии лабораторных мышей, только лучше, т.к. мыши хоть немного, но отличаются, а тут полная тождественность.
- Бактерии лучше мышей тем, что их можно создать много. И за счет этого хорошо оценить вероятность, с которой будут самоуничтожаться мутировавшие.
- Содержать их дешево, живут они мало.
- Нет никаких этических проблем, если потребуется облучать радиацией.
В общем с какой стороны ни посмотри — идеальный модельный организм для создания proof-of-concept.
Для исследований по борьбе с раком более сложный организм, чем бактерия, и не нужен. Нам ведь нужно добиться отсутствия мутаций или, по крайней мере, сильного их замедления именно в клетке. После успеха на бактериях можно будет переходить на культуры клеток человека in vitro, такие как HeLa.
Но начинать работать с HeLa, возможно, сложнее, чем с бактерией, так как генетического материала больше и поэтому потребуется придумывать более надежные контрольные суммы, умеющие работать с большими геномами.
Ещё более простой моделью, чем бактерии, для контрольных сумм могли бы стать митохондрии, которые ещё проще чем бактерии, тут любая плохо работающая контрольная сумма сгодится. Геном у них еще короче, а проблемы от испорченной ДНК в митохондриях реально есть (см. митохондриальные заболевания), плюс их можно подсаживать без отторжения разным людям. Так что митохондрии тоже могут стать кейсом для практического применения альфа-версии (недостаточно надежной) контрольных сумм.
5.5 Идеальный конечный результат — одна прививка, после которой человек не болеет раком
Идеальный конечный результат или идеальное конечное решение (ИКР), это эвристический приём из ТРИЗ, применяемый в целях раскрепощения мышления, чтобы найти самое сильное решение проблемы.
Для разных категорий людей ИКР будет отличаться. Для того, кто только рождается, было бы хорошо родиться уже с внедрёнными контрольными суммами. Тут речь идёт о дизайнерских детях. Конечно, это зависит от родителей, захотят ли они, чтобы их дети имели защиту от рака или нет.
Если же человек уже рождён, то наиболее подходящим вариантом видится “прививка от рака”, которая будет содержать в себе всё необходимое для внедрения контрольных сумм и их контроля.

6. Заключение. Что это даст?
6.1 Увеличение жизни в среднем на 10 лет для заболевших
К сожалению, каждый из нас знает ситуации, когда здоровые и даже молодые люди, в том числе дети, уходили из жизни из-за рака. Это ужасные трагедии, которые разбивают сердца родственникам и друзьям, что, в свою очередь, сокращает жизни близких из-за перенённого стресса и утраты.
Представим, что с помощью предлагаемых генетических контрольных сумм рак полностью побеждён, в этом случае все, кто мог потенциально умереть от него, проживут значительно дольше. Скорее всего до старости.
Если обратиться к статистике, а конкретнее к показателю ВОЗ под названием DALY (англ. disability-adjusted life years), обозначающему в сумме количество лет, потерянных (недожитых до среднего возраста смерти) по причине смерти людей от конкретной болезни и количество лет на инвалидности (нетрудоспособности) при этой болезни, то можно вычислить что при отсутствии рака жизнь больных им в среднем была бы дольше на 9.53 года.
Эту цифру получили простым делением из следующих фактов:
“DALY от онкозаболеваний в 2017 году было оценено в 233.5 млн. лет, из которых примерно 225 млн. лет приходится на потерянные годы жизни (YLL).”
…
“В 2017 году болели раком 24.5 млн. человек и 9.6 млн. человек скончались от онкологических заболеваний”. Источник.
Делим на 225 млн. потерянных лет жизни на 24.5 млн. человек болевших раком в 2017 году и получаем 9.5 года.
Другими побочными эффектами станут существенное повышение качества жизни тех кто мог бы заболеть, а также их близких. Все же остальные люди станут более уверены в завтрашнем дне.
Если же говорить о всей популяции, то в среднем же жизнь в отсутствие рака стала бы дольше примерно на 3.2 года. В опубликованном в 1990 г. исследовании утверждается, что “устранение всех форм рака (22.45% всех смертей в Соединенных Штатах в 1985 году) увеличило бы ожидаемую продолжительность жизни при рождении на 3.17 года для женщин и на 3.2 года для мужчин.
Введение механизма проверки контрольных сумм в геном, конечно же, не решит всех проблем человеческого организма, которые мешают ему существовать неограниченно долго. Дефектных клеток в организмах будет меньше. Но останутся другие факторы, отвечающие за старение.
Поскольку предусмотренной в описанном методе реакцией на несовпадение сумм является апоптоз, видимо, будет быстрее истощаться пул клеток, что нужно будет как-то компенсировать.
Старение и рак тесно взаимосвязаны. Рак является возраст-зависимым заболеванием, вероятность им заболеть с возрастом увеличивается.

Рис. 9. Число заболевших раком в течение года на 100 000 человек в зависимости от возраста. Источники (1, 2).
Вполне возможно, что механизм контрольных сумм в клетках снизит скорость старения, поскольку размножаться будут только полноценно функционирующие клетки.
6.2 Космические путешествия
С контрольными суммами в ДНК открываются новые перспективы для космических путешествий. Известно, что во многих областях космоса весьма высок уровень радиации. Это делает проблематичными дальние космические полёты, даже полёты на такую близкую к земле планету, как Марс (за 1 полёт на Марс человек получает почти 1 жизненную дозу радиации). Создание практически абсолютной системы защиты от рака применительно к космонавтам могло бы, возможно, создать предпосылки для колонизации других планет и, быть может, даже других звёздных систем.
6.3 Мы берём эволюцию полностью в свои руки. Спонтанные мутации невозможны
Эволюция привела к возникновению разумных существ, но её механизмы несовершенны и жестоки. Вполне возможно, что разум способен улучшать живые системы гораздо эффективнее, чем случайная, ненаправленная, природная эволюция.
Paradise engineering — философское направление, которое осмысляет постэволюционное улучшение биосферы с целью повышения комфорта для всех живущих.
Автор этого термина Дэвид Пирс считает генную модификацию важным направлением такого улучшения, и у него есть к этому основания, ведь вмешательство в геномы живых организмов уже повышает уровень жизни людей, и важность этой технологии постоянно растет.
Примером такого совершенствования человеческой природы может стать избавление человечества от рака, которое, возможно, произойдёт благодаря предлагаемой здесь идее.
Авторы: Сергей Каменев, Игорь Кирилюк, Владимир Бархатов, Валентин Перкин, Андрей Андрианов.
© 2020-2021 г.




