Прежде чем перейти к статье, хочу вам представить, экономическую онлайн игру Brave Knights, в которой вы можете играть и зарабатывать. Регистируйтесь, играйте и зарабатывайте!

Увидеть танец светлячков в сумеречном свете или свечение волн океана из-за необычных микроорганизмов это захватывающее и даже немного сказочное зрелище из мира дикой природы. Светлячки, к примеру, используют свое свечение для коммуникации, поиска партнера, а порой и для охоты. Для светлячков биолюминесценция является вполне естественным эффектом химических процессов, протекающих в их организме. Человек же может воссоздать подобный эффект с помощью технологий и применить его, к примеру, в медицинской диагностике. Последние несколько лет идет активная разработка различных систем биолюминесцентной визуализации (BLI от bioluminescent imaging), и вот ученые из университета Миссури (США) предложили свой вариант — недорогой, простой в использовании и, что самое главное, портативный. В чем особенности устройства, как именно проходит диагностика с его использованием, и насколько точны полученные таким методом данные? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования

Биолюминесценция у светлячков.
Если рассматривать BLI детальнее, то этот метод основан на использовании в качестве репортера* фермента люцифераза, который генерирует биолюминесцентный свет при окислении его субстрата — люциферина.
Репортер* — ген, который специально присоединяет к регуляторным последовательностям других генов для исследования проявлений генов в культурах клеток.Одно из первых применений BLI основывалось на конститутивной экспрессии фермента люциферазы в раковых клетках для мониторинга роста опухоли и метастазирования. Среди более современных применений стоит выделить клеточные зонды на основе люциферина, позволившие расширить спектр применения BLI для функциональной визуализации ферментативных и метаболических процессов. Главный принцип таких зондов основан на том, что люциферин с химическими клетками не является субстратом для люциферазы до тех пор, пока он не высвобождается или не освобождается в результате определенного представляющего интерес биологического процесса (например, селективного ферментативного расщепления; 1a). Интенсивность биолюминесцентного сигнала количественно коррелирует с количеством свободного люциферина, что отражает уровень функциональной активности биологического процесса, который исследуется этим методом.
Несмотря на свои преимущества, нынешние варианты BLI обладают рядом ограничений и проблем. К примеру, текущая система BLI основана на использовании клеток и животных, экспрессирующих трансгенную люциферазу, а потому может применяться к весьма ограниченному числу животных моделей болезней человека.
В дополнение к этому, современные инструменты для визуализации обычно включают небольшой светонепроницаемый «черный ящик» и охлаждаемую камеру с зарядовой связью (CCD от charge-coupled device) в качестве светового детектора. Эти технические особенности делают BLI стационарным, крайне дорогим и сложным в использовании, а также ограничивают использование BLI только для мелких животных, таких как мыши и крысы. К тому же во время подобных BLI исследований животное должно находиться под длительным наркозом, который может негативно повлиять на его здоровье и нарушить метаболизм.
Результатом вышеописанных технических особенностей является гибель огромного числа животных, ввиду высокоинвазивности методики. В качестве примера ученые приводят токсикологическое тестирование потенциальных терапевтических кандидатов для активации цитохрома P450 (CYP450), фермента печени, ответственного за дезактивацию большинства клинически используемых лекарств. Каждый год от этого тестирование гибнет сотни тысяч собак.
Посему изменение нынешних BLI систем важно не только с точки зрения экономии, простоты использования и точности анализов, но и с точки зрения сохранения жизней.
Чтобы решить эти проблемы, авторы рассматриваемого нами сегодня труда предложили свой вариант BLI устройства, которое они назвали PBL (от portable bioluminescent), т.е. портативная биолюминесцентная система.
Их разработка дает возможность проводить неинвазивные измерения биологических процессов в живом организме с использованием биоразлагаемой инъекционной «пробки» на основе люциферазы в сочетании с люцифериновым клеточным зондом и высокочувствительным портативным детектором света.
Ученые решили сконцентрировать свое внимание на исследовании ферментативных процессов, так как существует острая потребность в более эффективных методах оценки активности ферментов (например, CYP450) в живом организме. Для исследования возможностей PBL в аспекте внеклеточных ферментов был выбран дипептидилпептидаза 4 (DPP-4), так как этот фермент крайне важен в поиске лекарств от диабета второго типа и некоторых видов онкологии.
Результаты исследования
Изображение №1
На 1b показана схема системы PBL, состоящая из трех основных компонентов:
- функциональный биолюминесцентный зонд — соединение люциферина в клетке, которое может распознавать определенный биологический процесс (например, CYP450 или DPP-4; 1a);
- биосовместимая биолюминесцентная светопродуцирующая «пробка» (репортер) на основе люциферазы или устройство для инкапсуляции клеток;
- портативный датчик (детектор) света.
Как правило, в ходе классического исследования животному сначала вводят однократную дозу люциферинового зонда, инкапсулированного в клетку, с последующей подкожной инъекцией люциферазной пробки спустя несколько минут. Устройство клеточной инкапсуляции с трансплантированными клетками, экспрессирующими люциферазу, используется для длительного мониторинга биологических процессов (до 5 месяцев).
Затем световой датчик немедленно прикрепляется к люциферазной пробке, и биолюминесцентный сигнал записывается через определенные интервалы времени для получения максимального светового потока (1c).
После инъекции инкапсулированного зонда свободный люциферин высвобождается в исследуемом органе (например, в печени) в результате освобождения зонда за счет определенного биологического процесса или фермента (к примеру, CYP450; 1d).
Потом свободный люциферин мигрирует в кровоток и в конечном итоге достигает репортера на основе люциферазы, помещенного под кожу подопытного животного. Количество света, генерируемого люциферазной пробкой, пропорционально концентрации люциферина в кровотоке, что приводит к производству биолюминесцентного света, которое напрямую коррелирует с уровнем функциональной активности биологического процесса, который изучается в ходе конкретного исследования.
В рассматриваемом нами сегодня труде ученые во всех опытах использовали D-люциферин (X = O; 1a; далее по тексту будет просто «люциферин»). Но это не значит, что их методика работоспособна только с этим типом люциферина, она может быть адаптирована под любые люциферазы и соответствующие им субстраты.
Одним из важнейших элементов устройства является детектор света с высокой чувствительностью и низким уровнем шума, специально разработанный для PBL системы. Особенность этого датчика в том, что он мог отслеживать потоки биолюминесцентных фотонов, которые обычно относительно невелики.
В датчике присутствует большой кремниевый фотодиод (1 см2) в фотоэлектрическом режиме с трансимпедансным усилителем (утрировано говоря, преобразовывает входной ток в выходное напряжение), установленный в цилиндрический корпус диаметром 30 мм и высотой 40 мм. Полученное устройство напоминает стетоскоп и может быть легко применено к маленьким и крупным животным, а также к человеку.
«Рабочая поверхность» устройства механически защищает чувствительные электронные компоненты и содержит круглую оптическую апертуру диаметром 1 см.
Ученые выбрали фотодиод, а не камеру, по той причине, что первый может работать при комнатной температуре, обладает низкой стоимостью и низким уровнем шума (низкий темновой ток).
Для обнаружения низких уровней освещенности использовался операционный усилитель с низким уровнем шума, сконфигурированный как трансимпедансный усилитель. Коэффициент усиления был установлен на 1010 В/А с резистором обратной связи R = 10 ГигаОм.
Детектор выводит значение напряжения, которое пропорционально оптической мощности излучения, поглощаемой поверхностью диода:
V = P/r, где P — мощность излучения, V — напряжение, а r — коэффициент пропорциональности, называемый чувствительностью. Для определения r выполнялась калибровка детектора.
Вторым важным элементом системы является инъекционная пробка на основе люциферазы (или коротко «люциферазная пробка»). Эта пробка содержит рекомбинантный фермент люциферазы вместе с его кофакторами и полимерную матрицу, чтобы фермент и его кофакторы оставались неповрежденными под кожей подопытного (1b и 1c).
Пояснение принципа работы BLI.
Чтобы оптимизировать состав инъекционной люциферазной пробки и добиться яркого стабильного сигнала в живом организме, был проведен тест влияния различных компонентов на светоотдачу с помощью стационарного прибора BLI, оснащенного чувствительной CCD камерой. Анализ показал, что люминесценция, генерируемая люциферазной пробкой, прямо пропорциональна количеству фермента люциферазы, добавленного к пробке, и относительно не зависит от концентрации АТФ в диапазоне 1–10 мМ.
За счет этих данных был выбран определенный состав люциферазной пробки для всех последующих опытов на мышах (общий объем равен 100 мкл): 83 мкл Matrigel, 10 мкг фермента люциферазы, 10 мМ АТФ, 1 мМ Mg2+ и PBS.
Матрица Matrigel была выбрана для этого исследования, так как она нетоксична и легко вводится подкожно, а также производит более яркий и стабильный сигнал по сравнению с другими матрицами. В результате пробка на базе Matrigel сохраняла стабильность в течение 60 минут после инъекции, что позволяло непрерывно измерять биолюминесцентный сигнал.
Поскольку интенсивность света на поверхности зависит от глубины источника света, необходимо было оценить зависимость биолюминесцентного светового потока от глубины люциферазной пробки. Для этого был использован весьма необычный образец — кусок мяса из магазина. С его помощью ученые количественно оценили потерю сигнала в зависимости от толщины ткани. Как и ожидалось, интенсивность детектируемого света зависела от глубины источника света.
Любопытно то, что падение интенсивности сигнала не было столь значительным, как ожидалось при использовании обычной люциферазы светлячков (примерно в десять раз на глубине в 0.8 см). Даже на глубине в 1 см был виден отчетливый сигнал.
Далее необходимо было выяснить, пропорционально ли количество света, генерируемого люциферазной пробкой, концентрации люциферина в крови подопытных. Для этого разные концентрации раствора люциферина вводились подопытным внутрибрюшинно, после чего подкожно вводилась люциферазная пробка. После чего биолюминесцентный световой поток непрерывно измеряли для определения максимальной мощности оптического излучения (фотонов в секунду, т.е. максимальный поток фотонов).
Изображение №2
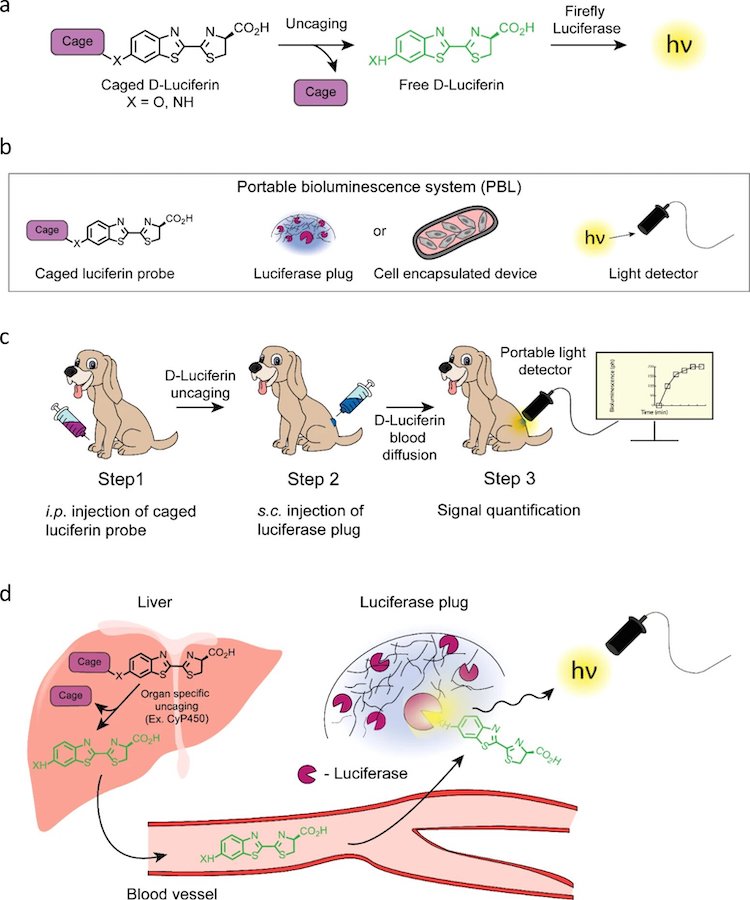
Анализ данных показал, что поток фотонов от люциферазной пробки линейно коррелирует с количеством введенного люциферина в достаточно большом диапазоне дозировок (150, 15 и 1.5 мг/кг). Следовательно, пробка может успешно использоваться для точного определения концентрации люциферина в крови подопытных (2a). На снимках 2b показаны световые сигналы подопытных (полученные с помощью CCD), которым вводили люциферазную пробку и три различных концентрации люциферина.
Далее были проведены аналогичные опыты, но уже с применением портативного детектора света (2c). Результаты (2d) показывают аналогичную линейную корреляцию между концентрацией люциферина и максимальной оптической силой, измеренной портативным детектором света. Даже уровень погрешности обоих методов сопоставим.
Это говорит о том, что метод PBL идеально подходит для высокоточной количественной оценки концентрации свободного люциферина в крови нетрансгенных животных, которые не экспрессируют фермент люциферазы.
На следующем этапе ученые проверяли, насколько эффективен их метод для определения ферментативной активности у живых мышей, а именно активности внеклеточного фермента. Для этого было подготовлено четыре группы мышей (по 5 особей).
Две разные дозы 5 и 10 мг/кг селективного ингибитора DPP-4 ситаглиптина (SIT от sitagliptin) в буфере PBS* вводили двум группам мышей, в то время как третья группа мышей получала чистый PBS (контрольная группа).
Натрий-фосфатный буфер (PBS)* — водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия.Спустя тридцать минут трем группам мышей делали инъекцию люциферинового зонда в клетке DPP-4, а еще через 10 минут — подкожную инъекцию люциферазной пробки. Четвертой (контрольной) группу также делали инъекцию пробки, но не вводили люцифериновый зонд.
От всех четырех групп мышей был получен сигнал, зафиксированный как классическим методом (IVIS Spectrum), так и с помощью портативного датчика света.

Изображение №3
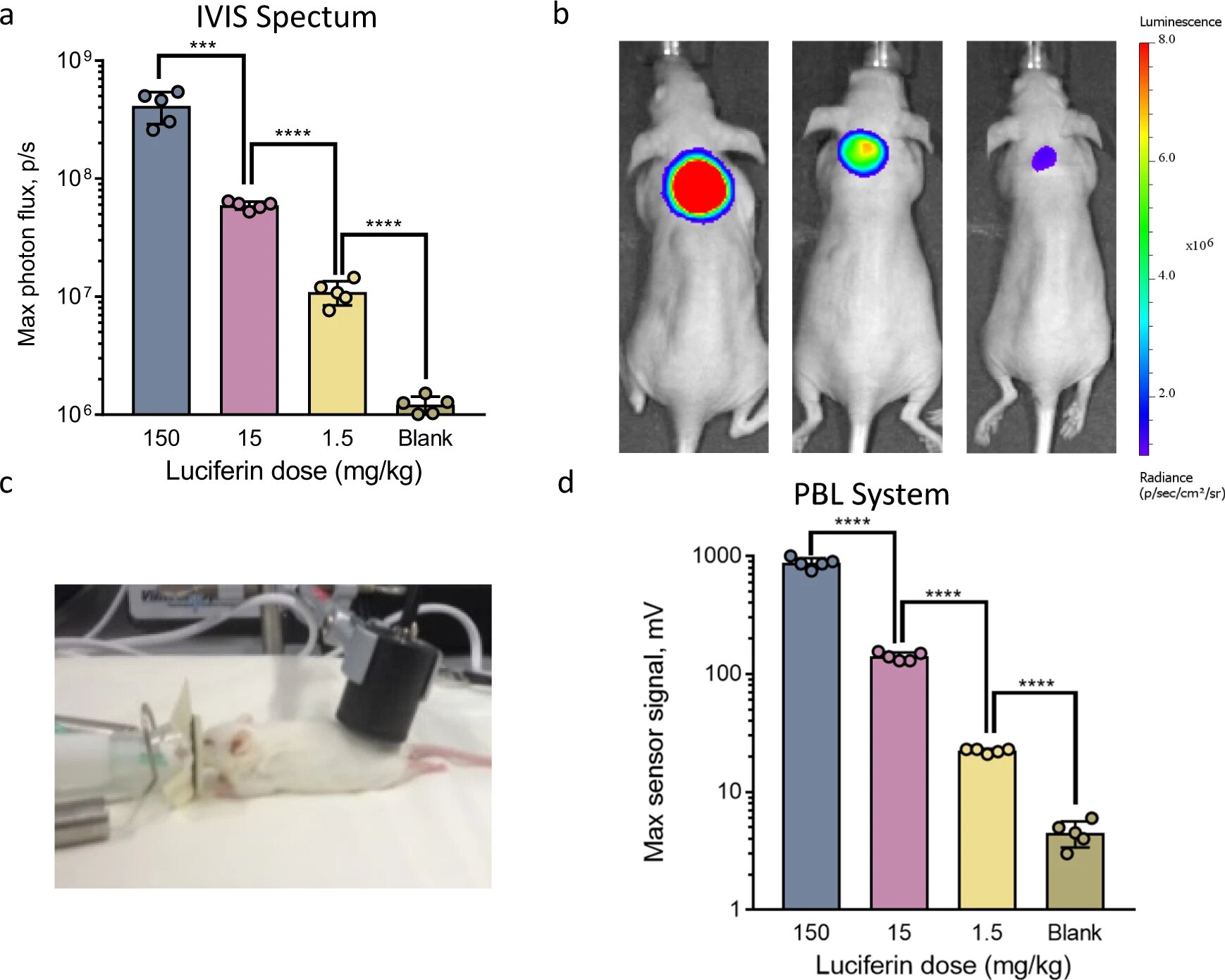
Наблюдалось дозозависимое снижение сигнала, полученного от животных, получавших ингибитор DPP-4. Подобные измерения полностью согласовывались между показаниями IVIS Spectrum и портативного светового детектора (3a и 3b).
Из этих результатов следует, что PBL может обеспечить точное считывание внеклеточной ферментативной активности у нетрансгенных животных неинвазивным способом. А полученные таким образом данные сопоставимы с данными, полученными с помощью классической технологии (т.е. IVIS).
Далее было проведено тестирование PBL в работе с внутриклеточными ферментами (CYP450). Для этого был использован CYP450 изофермент — цитохром P450 3A (Cyp3a), который является наиболее распространенным и универсальным изоферментом, участвующим в метаболизме лекарственных препаратов.
В этом случае было задействовано две группы мышей. Особям из одной внутрибрюшинно вводили дексаметазон (DEX от dexamethasone, доза 50 мг/кг), который вызывает активацию Cyp3a. Вторая группа мышей (контрольная) получала обычный раствор растительного масла. Через 24 часа обеим группам мышей вводили зонд люциферин-IPATM с последующей анестезией и получением сигнала с помощью IVIS Spectrum.
Изображение №4
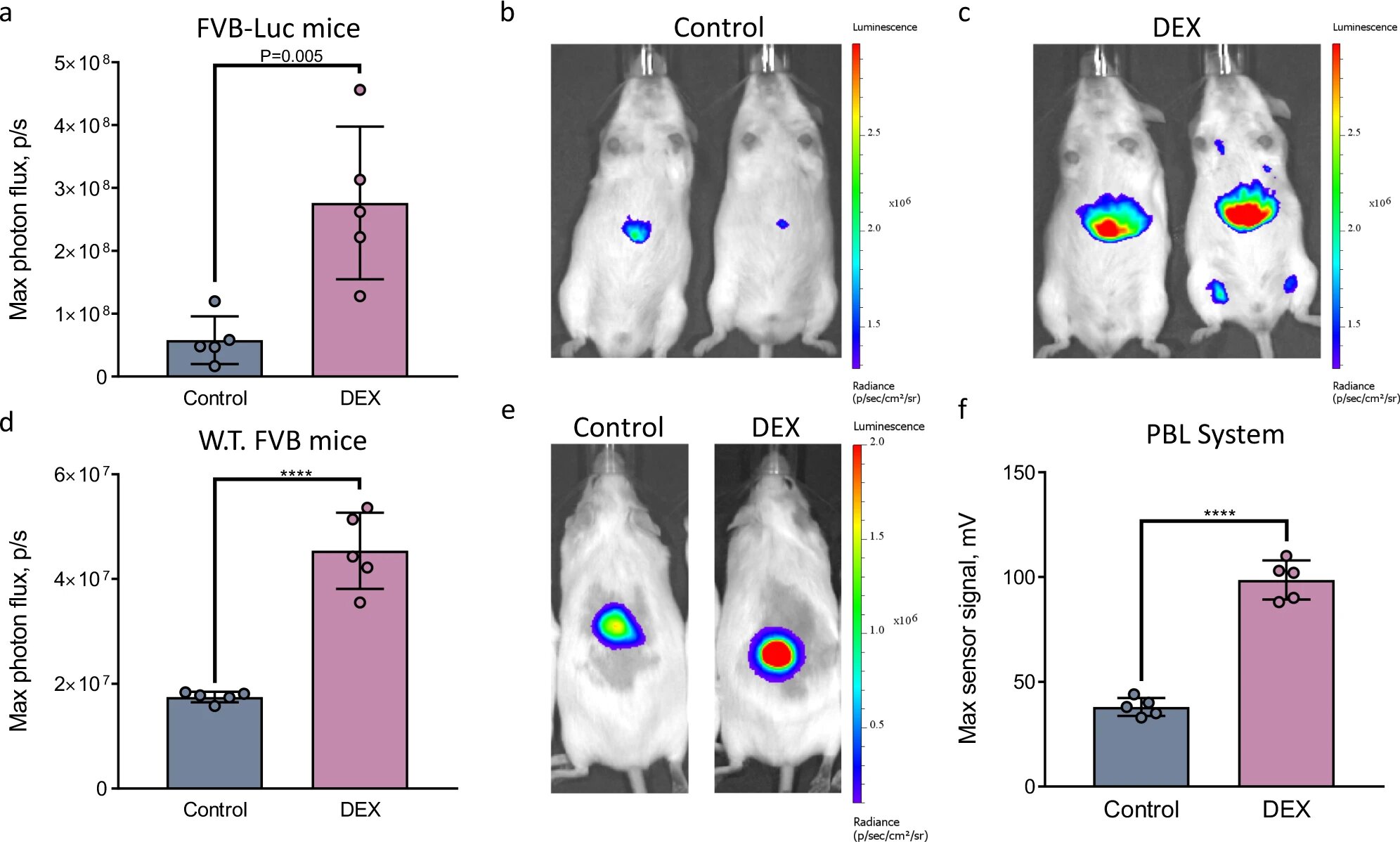
На изображениях 4a-4c видно, что биолюминесцентный сигнал от мышей, получивших DEX, был приблизительно в три раза выше, чем сигнал от контрольной группы. Это указывает на то, что зонд может успешно обнаруживать активацию Cyp3a непосредственно в живом организме после обработки мышей дексаметазоном.
Теперь необходимо было провести аналогичные опыты, но с применением метода PBL. Опять же было две группы мышей — контрольная и та, которой вводили DEX. Как и ранее, через 24 часа мышам вводили зонд люциферин-IPATM, а потом анестезировали, вводили люциферазную пробку и проводили визуализацию с помощью портативного детектора и IVIS Spectrum (для сравнения).
Как показано на 4d-4f, значительно более сильный биолюминесцентный сигнал был получен от особей с DEX, чем от контрольной группы, как в случае применения IVIS (4d-4e), так и портативного светового детектора (4е).
Одной из важнейших задач, которые поставили перед собой авторы PBL разработки, является возможность проводить неинвазивную визуализацию крупных животных (например, собак) и людей. Прежде всего был выполнен токсикологический анализ, установивший, что никаких отклонений в ответ на D-люциферин у собак не было выявлено.
Изображение №5 (предупреждение: на 5c снимки руки трупа человека)
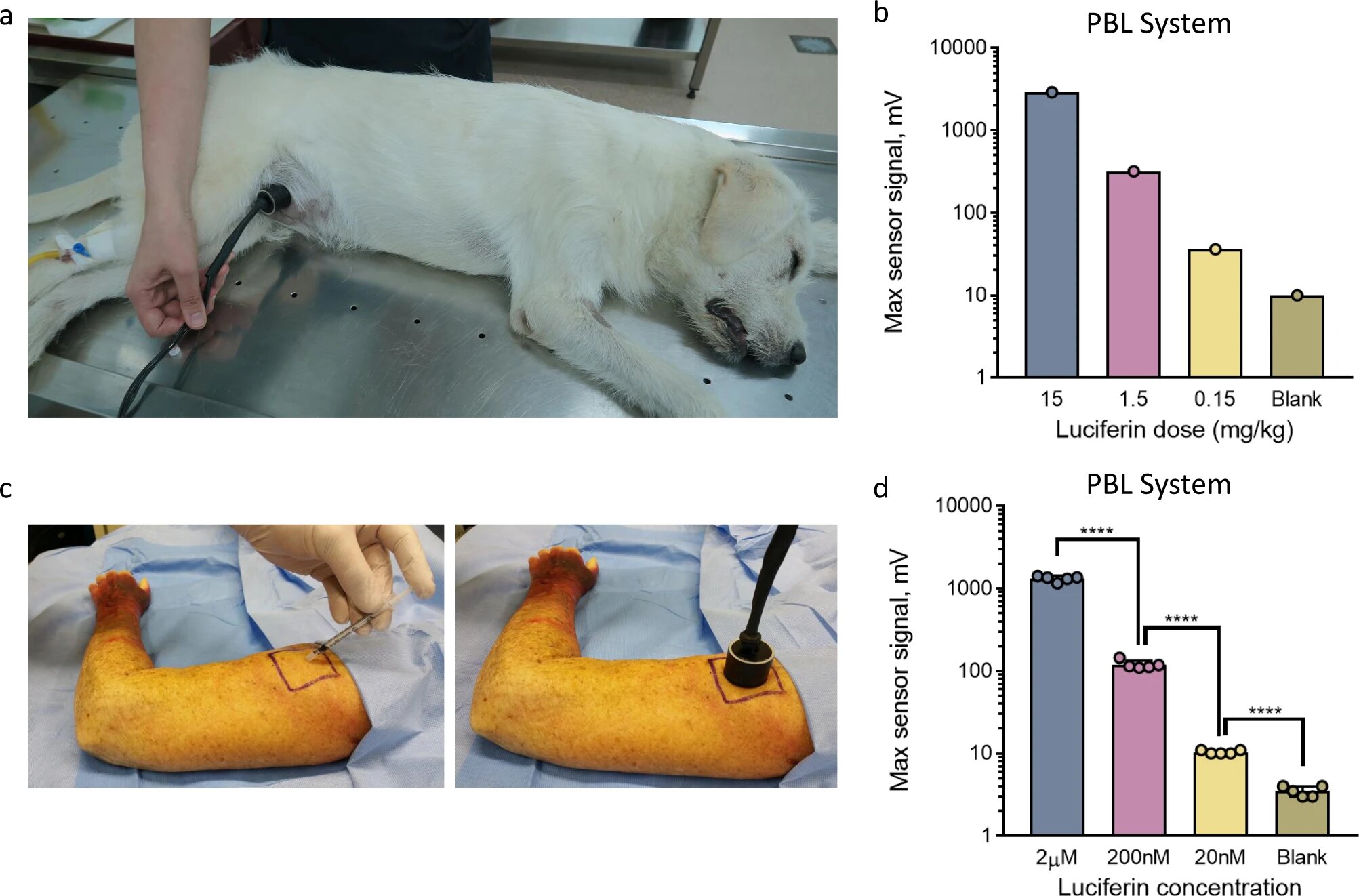

Далее была выполнена оценка пропорциональности генерируемого люциферазной пробкой света к концентрации введенного люциферина. Собак анестезировали, и люциферазную пробку имплантировали подкожно в брюшную полость. Затем вводили люциферин в различных концентрациях (15, 1.5 и 0.15 мг/кг) внутрибрюшинно с последующим размещением портативного детектора света непосредственно на области люциферазной пробки (5а).
На 5b видно, что максимальный световой выход линейно коррелировал с количеством введенного люциферина в большом диапазоне концентраций люциферина.
Данные, полученные во время тестов на собаках, полностью согласуются с данными тестов на мышах. В некоторых случаях сенсорный сигнал у собак был в 30 раз выше, чем у мышей (при дозе в 15 мг/кг).
В заключение была выполнена оценка эффективности PBL методики в рамках применения ее на людях. Для этих экспериментов было подготовлено 100 мкл люциферазной пробки с тремя различными дозами люциферина (конечные концентрации: 2 мкМ, 200 нМ и 20 нМ) с последующей инъекцией смеси под кожу трупа человека в область плеча (5c). Затем переносной световой детектор помещали непосредственно на люциферазную пробку. Длительность регистрации сигналов составляла 15 минут.
Даже при самой низкой концентрации люциферина наблюдался очень сильный сигнал, в три раза превышающий мощность фонового сигнала. В данном опыте сила сигнала также была пропорциональная концентрации люциферина в широком диапазоне величин (5d).
Для более подробного ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые решили усовершенствовать имеющуюся на данный момент технологию биолюминесцентной визуализации, сделав ее портативной, неинвазивной, легкой в применении и, что самое важное, безопасной для животных и человека.
Принцип работы устройства достаточно прост. В тело вводится зонд для визуализации, который достигает нужного участка (например, печени). Уровень биологической активности участка определяет количество люциферина, которое попадает в кровоток. Когда люциферин достигает области, где размещено устройство, возникает биохимическая реакция с выделением света. Портативный детектор света прикладывается к участку тела, где устройство ближе всего, и замеряет интенсивность света, уровень которого коррелирует с количеством присутствующего люциферина.
Такой способ помогает определить биологические процессы, протекающие в то или ином органе/тканях, в ответ на лечение. Следовательно, медики и ученые, разрабатывающие лекарства, могут понять, работает ли препарат или нет.
Данная разработка также порадует тех, кому не безразлична судьба подопытных животных, которые при обычных условиях могут сильно пострадать или даже погибнуть в ходе биолюминесцентной визуализации. Из-за высокой смертности ученые вынуждены использовать большое число подопытных, чтобы получить необходимый результат того или иного исследования. Неинвазивность PBL метода не только значительно снижает риск для животных, но и нивелирует необходимость в использовании большого числа животных.
Точность портативного PBL не уступает своим стационарным конкурентам, что может сильно ускорить и упростить диагностику пациентов до и во время лечения. Если попытаться одним словом описать, что же PBL в итоге дает, то это слово будет «время». Скорость и простота выполнения PBL диагностики экономят драгоценное время медиков, которое в противном случае ушло бы на выполнение какой-то сложной диагностической процедуры без каких-либо гарантий, что она покажет нужные результаты.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?






